题目内容
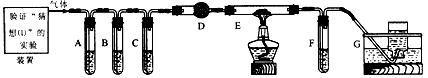
 某化学学习小组同学用下列装置制备、收集二氧化氮气体,并探究其性质(部分夹持装置已略去).
某化学学习小组同学用下列装置制备、收集二氧化氮气体,并探究其性质(部分夹持装置已略去).(1)装置A中的分液漏斗中盛装的液体是
浓硝酸
浓硝酸
,烧瓶中预先加入的是铜屑,铁的价格比铜的价格低,此处用铜屑、不用铁屑的原因是常温下,Fe在浓硝酸中发生钝化,阻止反应进一步发生
常温下,Fe在浓硝酸中发生钝化,阻止反应进一步发生
.(2)干燥管B、D中盛装的干燥剂可以是
无水氯化钙
无水氯化钙
(填“浓硫酸”、“无水氯化钙”或“碱石灰”),干燥管D中干燥剂的作用是防止E装置中的水蒸气进入集气瓶C中
防止E装置中的水蒸气进入集气瓶C中
.(3)装置E的作用是吸收尾气,吸收过程中发生反应的化学方程式为(补全下面的化学方程式,其中口中填写化学式的系数):□NaOH+□NO2
|
NaNO3
NaNO3
+口NaNO2+□H2O.(4)若用上述装置收集到了NO,采用的收集装置是
G
G
(填“F”或“G”),可以连接在装置中的a或b或c或d
a或b或c或d
(填“a”、“b”、“C”或“d”)位置.分析:(1)根据制备、收集二氧化氮气体的原理,需用铜和浓硝酸反应,所以装置A中的分液漏斗中盛装的液体是浓硝酸;不用铁屑的原因是Fe在浓硝酸中会发生钝化;
(2)干燥二氧化氮气体,干燥管B、D中只能盛装固体干燥剂,因碱石灰与二氧化氮反应,所以选择无水氯化钙;干燥管D中干燥剂的作用是防止E装置中的水蒸气进入集气瓶C中;
(3)根据氧化还原反应的原理结合同一化学反应方程式中各元素的原子守恒判断物质的化学式;
(4)利用一氧化氮难溶于水的性质收集NO,据此选择装置.
(2)干燥二氧化氮气体,干燥管B、D中只能盛装固体干燥剂,因碱石灰与二氧化氮反应,所以选择无水氯化钙;干燥管D中干燥剂的作用是防止E装置中的水蒸气进入集气瓶C中;
(3)根据氧化还原反应的原理结合同一化学反应方程式中各元素的原子守恒判断物质的化学式;
(4)利用一氧化氮难溶于水的性质收集NO,据此选择装置.
解答:解:(1)根据制取NO2的反应原理:Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O可知,是固体和液体在常温下的反应,所以装置A中的分液漏斗中盛装的液体是浓硝酸;烧瓶中预先加入的是铜屑,铁的价格比铜的价格低,此处用铜屑、不用铁屑的原因是常温下,Fe在浓硝酸中发生钝化,阻止反应进一步发生,无法制取NO2,
故答案为:浓硝酸;常温下,Fe在浓硝酸中发生钝化,阻止反应进一步发生;
(2)二氧化氮是酸性气体,不能用碱性干燥剂,所以不能选碱石灰,干燥管B、D中只能盛装固体干燥剂,所以不能选浓硫酸,只能选无水氯化钙,E装置中的水蒸气可进入集气瓶C中,所以使用装置干燥管D,防止E装置中的水蒸气进入集气瓶C中,
故答案为:无水氯化钙;防止E装置中的水蒸气进入集气瓶C中;
(3)根据氧化还原反应的原理知:反应物NO2中氮元素的化合价是+4价,产物NaNO2中氮元素的化合价是+3价,所以N元素化合价最高的含氮化合物是NaNO3,结合同一化学反应方程式中各元素的原子守恒判断,该反应的方程式为2NO2+2NaOH=NaNO2+NaNO3+H2O,
故答案为:2NO2+2NaOH=NaNO2+NaNO3+H2O;
(4)二氧化氮和水反应生成一氧化氮,一氧化氮为无色难溶于水密度与空气接近的气体,所以用排水法收集NO,选择装置G,可以连接在装置中的a或b或c或d位置任一位置均可,
故答案为:G;a或b或c或d;
故答案为:浓硝酸;常温下,Fe在浓硝酸中发生钝化,阻止反应进一步发生;
(2)二氧化氮是酸性气体,不能用碱性干燥剂,所以不能选碱石灰,干燥管B、D中只能盛装固体干燥剂,所以不能选浓硫酸,只能选无水氯化钙,E装置中的水蒸气可进入集气瓶C中,所以使用装置干燥管D,防止E装置中的水蒸气进入集气瓶C中,
故答案为:无水氯化钙;防止E装置中的水蒸气进入集气瓶C中;
(3)根据氧化还原反应的原理知:反应物NO2中氮元素的化合价是+4价,产物NaNO2中氮元素的化合价是+3价,所以N元素化合价最高的含氮化合物是NaNO3,结合同一化学反应方程式中各元素的原子守恒判断,该反应的方程式为2NO2+2NaOH=NaNO2+NaNO3+H2O,
故答案为:2NO2+2NaOH=NaNO2+NaNO3+H2O;
(4)二氧化氮和水反应生成一氧化氮,一氧化氮为无色难溶于水密度与空气接近的气体,所以用排水法收集NO,选择装置G,可以连接在装置中的a或b或c或d位置任一位置均可,
故答案为:G;a或b或c或d;
点评:本题主要考查制备、收集二氧化氮气体实验装置的选取、化学方程式的书写,掌握硝酸、二氧化氮的性质是解答本题的关键,题目难度中等.

练习册系列答案
 轻松课堂单元测试AB卷系列答案
轻松课堂单元测试AB卷系列答案 小题狂做系列答案
小题狂做系列答案
相关题目

 某化学学习小组同学用下列装置制备、收集二氧化氮气体,并探究其性质(部分夹持装置已略去).
某化学学习小组同学用下列装置制备、收集二氧化氮气体,并探究其性质(部分夹持装置已略去). □______+口NaNO2+□H2O.
□______+口NaNO2+□H2O. 3Cu+N2+3H2O
3Cu+N2+3H2O  Cu+Cu2+ 。
Cu+Cu2+ 。