题目内容
【题目】某化学活动小组设计如下图所示(部分夹持装置已略去)实验装置,以探究潮湿的Cl2与Na2CO3反应得到的气态物质。
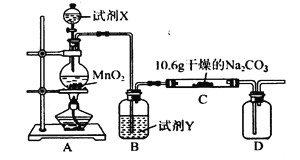
(1)装置A中发生反应的离子方程式为_______________________________________。
(2)装置B中试剂Y应为_________________。
(3)已知在装置C中通入一定量的氯气后,测得D中只有一种常温下为黄红色的气体(含氯氧化物),装置C中只有氯化钠和碳酸氢钠。若C中有0.1 mol Cl2参加反应,可推知C中反应生成的含氯氧化物为______________(写化学式)。
(4)该实验装置中明显存在不足之处,改进的措施为____________________________。
【答案】 MnO2+4H++2Cl- ![]() Mn2++Cl2↑+2H2O 饱和食盐水(或饱和氯化钠溶液) Cl2O 在装置D后连接一尾气处理装置(或连接一盛有NaOH溶液的洗气瓶)
Mn2++Cl2↑+2H2O 饱和食盐水(或饱和氯化钠溶液) Cl2O 在装置D后连接一尾气处理装置(或连接一盛有NaOH溶液的洗气瓶)
【解析】本题考查了物质性质验证的实验设计,步骤分析判断,现象分析理解,掌握物质性质和实验设计方法是解题关键。
(1)实验室制备氯气,结合装置分析可知是利用二氧化锰和浓盐酸加热反应生成氯气,反应的离子方程式为:MnO2+4H++2Cl- ![]() Mn2++Cl2↑+2H2O。 (2) 实验室制备氯气中含有氯化氢气体,需要用饱和食盐水除去。(3)C中有0.1mol氯气参加反应,装置C中通入一定量的氯气后,测得D中只有一种常温下黄红色的气体,反应为Cl2+Na2CO3→NaHCO3+NaCl+X,依据氧化还原反应电子守恒计算判断氯元素化合价为+1价,可推知C中反应生成的含氯氧化物为Cl2O。(4)实验过程中产生氯气是有毒气体,不能排放到空气中,而装置D后没有尾气吸收装置。
Mn2++Cl2↑+2H2O。 (2) 实验室制备氯气中含有氯化氢气体,需要用饱和食盐水除去。(3)C中有0.1mol氯气参加反应,装置C中通入一定量的氯气后,测得D中只有一种常温下黄红色的气体,反应为Cl2+Na2CO3→NaHCO3+NaCl+X,依据氧化还原反应电子守恒计算判断氯元素化合价为+1价,可推知C中反应生成的含氯氧化物为Cl2O。(4)实验过程中产生氯气是有毒气体,不能排放到空气中,而装置D后没有尾气吸收装置。

【题目】下列离子方程式的书写及评价均合理的是( )
选项 | 离子方程式 | 评价 |
A | 将2 mol Cl2通入含1 mol FeI2的溶液中: 2Fe2++2I-+2Cl2===2Fe3++4Cl-+I2 | 正确;Cl2过量,可将Fe2+、I-均氧化 |
B | Ba(HCO3)2溶液与足量的NaOH溶液反应: Ba2++HCO3-+OH-===BaCO3↓+H2O | 正确;酸式盐与碱反应生成正盐和水 |
C | 过量SO2通入NaClO溶液中: SO2+H2O+ClO-===HClO+HSO3- | 正确;说明酸性:H2SO3强于HClO |
D | 1 mol/L的NaAlO2溶液和2.5 mol/L的HCl溶液等体积混合: 2AlO2-+5H+===Al3++Al(OH)3↓+H2O | 正确;第一步反应和第二步反应消耗的H+的物质的量之比为2∶3 |
A. A B. B C. C D. D