题目内容
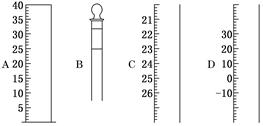
(1)如图为常见仪器的部分结构:
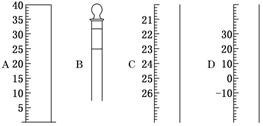
请写出仪器名称:
A________,B________,C________,D________。
(2)指出在使用下列仪器(已经洗涤干净)或用品时的第一步操作:
①石蕊试纸(检验气体)________。
②容量瓶________。
③酸式滴定管________。
④集气瓶(收集HCl气体)________。
【答案】
(1)量筒 容量瓶 滴定管 温度计 (2)①用蒸馏水润湿 ②检查是否漏水
③检查是否漏水,活塞转动是否灵活 ④干燥
【解析】考查常见仪器的识别及基本实验操作。
(1)根据仪器的构造及刻度线可知,四种仪器分别是量筒、容量瓶、滴定管、温度计。
(2)①用石蕊试纸检验气体的性质时,事先试纸应该湿润用蒸馏水润湿。
②使用容量瓶之前必需检查是否漏水。
③同样在使用酸式滴定管之前也必需检查是否漏水,以及活塞转动是否灵活等。
④干燥氯化氢极易溶于水,所以收集氯化氢的集气瓶必需时干燥的。

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目