题目内容
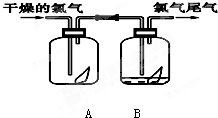
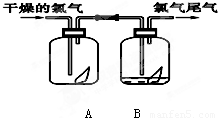
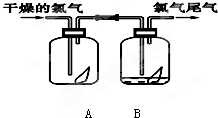 下列是探究氯气某性质的实验装置图:
下列是探究氯气某性质的实验装置图:请填写下列空白
(1)该实验的目的是探究氯气还是氯水具有漂白性.
(2)该实验的现象是:A装置中红纸条
不褪色
不褪色
,B装置中红纸条褪色
褪色
(填“褪色”或“不褪色”)实验结论是:
干燥的氯气不具有漂白性,湿润的氯气具有漂白性
干燥的氯气不具有漂白性,湿润的氯气具有漂白性
.(3)实验后氯气尾气通入
NaOH
NaOH
中处理,反应方程式为Cl2+2NaOH=NaCl+NaClO+H2O
Cl2+2NaOH=NaCl+NaClO+H2O
.分析:氯气不具有漂白性,可与水反应:Cl2+H2O?H++Cl-+HClO,生成的HClO具有漂白性,氯气有毒,不能直接排放到空气中,可用NaOH溶液吸收,发生:Cl2+2NaOH=NaCl+NaClO+H2O,以此解答该题.
解答:解:(2)氯气不具有漂白性,可与水反应:Cl2+H2O?H++Cl-+HClO,生成的HClO具有漂白性,可使湿润的有色布条褪色,
故答案为:不褪色;褪色;干燥的氯气不具有漂白性,湿润的氯气具有漂白性;
(3)氯气有毒,不能直接排放到空气中,可用NaOH溶液吸收,发生:Cl2+2NaOH=NaCl+NaClO+H2O,
故答案为:NaOH;Cl2+2NaOH=NaCl+NaClO+H2O.
故答案为:不褪色;褪色;干燥的氯气不具有漂白性,湿润的氯气具有漂白性;
(3)氯气有毒,不能直接排放到空气中,可用NaOH溶液吸收,发生:Cl2+2NaOH=NaCl+NaClO+H2O,
故答案为:NaOH;Cl2+2NaOH=NaCl+NaClO+H2O.
点评:本题考查氯气的性质,题目难度不大,本题注意氯气与水、碱反应的性质,注意氯气和HClO的区别.

练习册系列答案
相关题目
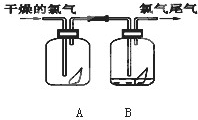 如图是探究氯气某性质的实验装置图:
如图是探究氯气某性质的实验装置图: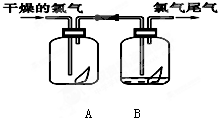 下列是探究氯气某性质的实验装置图:
下列是探究氯气某性质的实验装置图: