题目内容
【题目】弱酸溶液中存在电离平衡。室温下,几种弱酸的电离常数如下:
①醋酸 Ka=1.8×10-5 ②草酸 Ka1=5.9×10-2,Ka2=6.4×10-5
③硼酸 Ka=5.8×10-10 ④邻-苯二甲酸 Ka1=1.1×10-3,Ka2=3.9×10-6
(1)25 ℃时,0.1 mol/L的上述四种酸溶液,pH由小到大的顺序是__________(用序号表示)。
(2)25 ℃时,0.1 mol/L醋酸溶液的pH=______(lg1.8=0.26)。已知:弱电解质在溶液中达到电离平衡时,溶液中已经电离的电解质分子数占原来电解质总分子数的百分数叫电离度。将0.1 mol/L醋酸溶液稀释10倍,其电离度变为原来的______倍(用代数式表示)。
(3)Na2C2O4第一步水解反应的平衡常数表达式是__________,室温下,向0.01 mol/LNa2C2O4溶液中滴加盐酸至pH=1时,溶液中HC2O4-与H2C2O4物质的量浓度之比为______。
【答案】 ②④①③ 2.9 ![]() Kh=
Kh=![]() 0.59
0.59
【解析】(1)电离常数越大,酸性越强,则25℃时,0.1mol/L的上述四种酸溶液,pH由小到大的顺序是②④①③。(2)根据醋酸的电离平衡常数可知25 ℃时,0.1mol/L醋酸溶液中氢离子浓度是![]() ,所以溶液的pH≈2.9。将0.1mol/L醋酸溶液稀释10倍,其电离度变为原来的
,所以溶液的pH≈2.9。将0.1mol/L醋酸溶液稀释10倍,其电离度变为原来的 倍。(3)Na2C2O4第一步水解反应的方程式为C2O42-+H2O
倍。(3)Na2C2O4第一步水解反应的方程式为C2O42-+H2O![]() HC2O4-+OH-,则平衡常数表达式是K=
HC2O4-+OH-,则平衡常数表达式是K=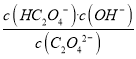 ,室温下,向0.01mol/LNa2C2O4溶液中滴加盐酸至pH=1时,溶液中HC2O4-与H2C2O4物质的量浓度之比为
,室温下,向0.01mol/LNa2C2O4溶液中滴加盐酸至pH=1时,溶液中HC2O4-与H2C2O4物质的量浓度之比为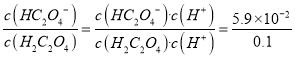 =0.59。
=0.59。

练习册系列答案
相关题目

