题目内容
15. 某同学设计如下实验以探究氯、溴、碘的非金属性强弱的递变规律,实验装置如图所示.已知常温下高锰酸钾与浓盐酸混合可产生氯气.
某同学设计如下实验以探究氯、溴、碘的非金属性强弱的递变规律,实验装置如图所示.已知常温下高锰酸钾与浓盐酸混合可产生氯气.(1)写出装置B中发生反应的离子方程式:Cl2+2I-=2Cl-+I2.向反应后装置B的溶液中加入CCl4,充分振荡后的现象为液体分层,下层液体呈紫色,上层液体接近无色.
(2)请完成上述D处实验装置图,装置D的作用是吸收尾气.
(3)在整个实验过程中,只需再添一个小实验,即可得出结论还原性:I->Br->Cl-,该实验的步骤是再另取少量的碘化钾溶液于试管中,向其中滴加少量溴水,观察溶液颜色变化.
分析 探究氯、溴、碘的非金属性强弱的递变规律,根据实验装置图可知,实验原理为浓盐酸与高锰酸钾反应生成氯气,氯气通入碘化钾溶液中,溶液出现紫红色,有碘单质生成,说明氯的非金属性强于碘,由于B装置中是少量碘化钾溶液,所以有多余的氯气再通入溴化钾溶液,溶液出现橙红色,有溴单质生成,说明氯的非金属性强于溴,再另取少量的碘化钾溶液于试管中,向其中滴加少量溴水,若溶液出现红色,有碘单质生成,即说明溴的非金属性强于碘,装置中挥发出来的溴或氯气都有毒,会污染空气,所以要用氢氧化钠溶液吸收,据此答题.
解答 解:探究氯、溴、碘的非金属性强弱的递变规律,根据实验装置图可知,实验原理为浓盐酸与高锰酸钾反应生成氯气,氯气通入碘化钾溶液中,溶液出现紫红色,有碘单质生成,说明氯的非金属性强于碘,由于B装置中是少量碘化钾溶液,所以有多余的氯气再通入溴化钾溶液,溶液出现橙红色,有溴单质生成,说明氯的非金属性强于溴,再另取少量的碘化钾溶液于试管中,向其中滴加少量溴水,若溶液出现红色,有碘单质生成,即说明溴的非金属性强于碘,装置中挥发出来的溴或氯气都有毒,会污染空气,所以要用氢氧化钠溶液吸收,
(1)装置B中发生反应为氯气置换碘,反应的离子方程式为Cl2+2I-=2Cl-+I2,碘易溶于CCl4,向反应后装置B的溶液中加入CCl4,碘被CCl4萃取出来,所以充分振荡后的现象为液体分层,下层液体呈紫色,上层液体接近无色,
故答案为:Cl2+2I-=2Cl-+I2;液体分层,下层液体呈紫色,上层液体接近无色;
(2)装置中挥发出来的溴或氯气都有毒,会污染空气,所以要用氢氧化钠溶液吸收,所以D装置应用导管将气体通入氢氧化钠溶液中,图为 ,装置D的作用是吸收尾气,
,装置D的作用是吸收尾气,
故答案为: ;吸收尾气;
;吸收尾气;
(3)在整个实验过程中,再另取少量的碘化钾溶液于试管中,向其中滴加少量溴水,观察溶液颜色变化,若溶液出现红色,有碘单质生成,则说明溴的非金属性强于碘,即可得出结论还原性:I->Br->Cl-,
故答案为:再另取少量的碘化钾溶液于试管中,向其中滴加少量溴水,观察溶液颜色变化.
点评 本题考查元素金属性、非金属性强弱的实验设计,题目难度中等,注意把握比较金属性、非金属性的角度,把握实验方法.

 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案①弱酸与盐溶液反应生成强酸
②两种氧化物发生反应有气体生成
③两种酸的溶液充分反应后溶液呈中性
④复分解反应中既没有生成水,也没有生成沉淀和气体
⑤两种无色气体常温常压下混合后气体颜色加深
⑥有单质生成的非氧化还原反应.
| A. | 全部 | B. | 只有①③⑤ | C. | 只有②④⑥ | D. | 只有①②③ |
| A. | 元素的性质随着相对原子质量的递增而呈周期性变化 | |
| B. | 两个原子如果核外电子排布相同,一定是同一种元素 | |
| C. | 原子的次外层电子数不一定是8个 | |
| D. | 一切原子的原子核都是由质子和中子构成 |
| A. | 两种物质的组成元素相同,各元素的质量分数也相同,则两者一定互为同分异构体 | |
| B. | 分子式为CnH2n的化合物,可能使酸性KMnO4溶液褪色,也可能不使其褪色 | |
| C. | 通式相同,分子组成上相差一个或若干个CH2原子团的化合物,一定互为同系物 | |
| D. | 凡含有苯环的物质都是芳香烃 |
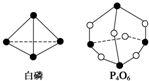 化学键的键能是形成(或断开)1mol化学键时释放(或吸收)的能量.已知白磷和P4O6的分子结构如图所示,现提供以下化学键的键能(kJ•mol-1):P-P:198 P-O:360 O═O:498若生成1mol P4O6,则反应P4(白磷)+3O2═P4O6中的能量变化为( )
化学键的键能是形成(或断开)1mol化学键时释放(或吸收)的能量.已知白磷和P4O6的分子结构如图所示,现提供以下化学键的键能(kJ•mol-1):P-P:198 P-O:360 O═O:498若生成1mol P4O6,则反应P4(白磷)+3O2═P4O6中的能量变化为( )| A. | 吸收1 638 kJ能量 | B. | 放出1 638 kJ能量 | ||
| C. | 吸收126 kJ能量 | D. | 放出126 kJ能量 |
| A. | 石油经过分馏及裂化等方法得到的物质均为纯净物 | |
| B. | 乙酸乙酯、油脂、葡萄糖、蛋白质均可以发生水解反应 | |
| C. | 化合物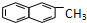 是苯的同系物 是苯的同系物 | |
| D. | 地沟油和矿物油可通过加足量的氢氧化钠溶液加热后的不同现象加以区别 |
| 实验方案 | 实验现象 |
| ①镁条除去氧化膜后,放入试管中,加入少量水,加热至沸腾;再向溶液中滴加酚酞溶液 | A.浮在水面上,熔成小球,四处游动,发出“嘶嘶”声,随之消失,溶液变红色 |
| ②向新制得的Na2S溶液中滴加新制的氯水 | B.有气体产生,溶液变成浅红色 |
| ③将小块金属钠放入滴有酚酞溶液的冷水中 | C.剧烈反应,迅速产生大量无色气体 |
| ④将除去氧化膜的镁条投入稀盐酸中 | D.反应不十分剧烈,产生无色气体 |
| ⑤将除去氧化膜的铝条投入稀盐酸中 | E.生成白色胶状沉淀,继而沉淀消失 |
| ⑥向A1Cl3溶液中滴加NaOH溶液至过量 | F.生成淡黄色沉淀 |
(1)实验目的:研究第3周期元素性质的递变规律.
(2)实验用品:
试剂:金属钠,镁条,铝条,稀盐酸,新制氯水,新制Na2S溶液,AlCl3溶液,NaOH
溶液,酚酞溶液等.
仪器:砂纸,试管,试管夹,①酒精灯,火柴,胶头滴管,烧杯,镊子,小刀,玻璃片,②滤纸等.
(3)实验内容:
| 实验方案 | ② | ④ | ⑥ |
| 实验现象(填A~F) |
②的离子方程式S2-+Cl2=2Cl-+S↓.
(4)实验结论:第3周期,随着原子序数的递增,元素的金属性减弱,非金属性增强;.
①碳酸 ②乙醇 ③苯酚 ④乙酸
Ⅰ甲同学设计并实施了如下实验方案.
| 编号 | 实验操作 | 实验现象 | 结论及解释 |
1 | 分别取4中溶液,滴加紫色石蕊溶液 | 溶液变红的是① ④溶液 | 略 |
2 | 向含酚酞的NaOH溶液中,各滴加等量②③两 | ②中无明显现象 ③中红色明显变浅 | 滴加③时反应的化学的化学方程式: |
| 3 | 测定CH3COOH溶液 与H2CO3溶液的溶液的酸性 | 略 | CH3COOH溶液的酸性远大于H2CO3溶液 |
| 4 | 将CO2通入C6H5ONa溶液中 | 反应的化学方程式: | |
| 结论:由强到弱顺序(填序号) | |||
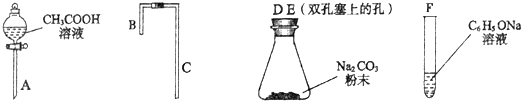
利用上述仪器组装实验装置,其中A管插入(填字母,下同)D(或E)中,B管插入E(或D)中,C管插入F中.
Ⅲ丙同学认为乙同学的实验设计不完善,请说明不完善的理由因乙酸有挥发性,制得的CO2中含有乙酸,如何改正才能使乙同学的实验设计更加完善,请说明在试管F之前增加了一个盛有饱和NaHCO3溶液的洗气装置.