题目内容
50℃时,下列各溶液中,离子的物质的量浓度关系正确的是
| A.饱和纯碱(Na2CO3)溶液中:c(Na+)=2c(CO32-) |
| B.pH=4的醋酸中:c(H+)=1.0×10-4mol·L-1 |
| C.0.10mol/L醋酸钠溶液中:c(Na+)+c(H+)=c(CH3COO-)+c(OH-) |
| D.pH=12的纯碱溶液中:c(OH-)=1.0×10-2mol·L-1 |
BC
解析试题分析:A、碳酸钠溶于水CO32-水解,因此在碳酸钠溶液中c(Na+)>2c(CO32-),A不正确;B、溶液中氢离子浓度的负对数等于pH,因此pH=4的醋酸中:c(H+)=1.0×10-4mol·L-1,B正确;C、根据电荷守恒可知,在0.10mol/L醋酸钠溶液中:c(Na+)+c(H+)=c(CH3COO-)+c(OH-),C正确;D、水的离子积常数受温度影响,因此在不能确定溶液温度的条件下,无法计算pH=12的纯碱溶液中c(OH-),只能得出c(H+)=1.0×10-12mol·L-1,D不正确,答案选BC。
考点:考查溶液中离子浓度大小比较以及pH和水的离子积常数计算

练习册系列答案
 夺冠金卷全能练考系列答案
夺冠金卷全能练考系列答案
相关题目
下图是用未知浓度的NaOH溶液来滴定10mL盐酸(标准液)所得的曲线(25℃),则下列说法不正确的是( )
| A.标准液盐酸的浓度为0.1 mol/L |
| B.NaOH溶液的浓度为0.05 mol/L |
| C.滴定终点时,俯视碱式滴定管读数,所测NaOH溶液浓度会偏高 |
| D.指示剂变色时,说明盐酸与NaOH恰好完全反应 |
在0.1 mol·L-1的CH3COOH溶液中存在如下电离平衡:CH3COOH CH3COO-+H+。对于该平衡,下列叙述正确的是
CH3COO-+H+。对于该平衡,下列叙述正确的是
| A.加水,反应速率增大,平衡向逆反应方向移动 |
| B.加入少量NaOH固体,平衡向正反应方向移动 |
| C.滴加少量0.1 mol·L-1HCl溶液,溶液中c(H+)减少 |
| D.加入少量CH3COONa固体,平衡向正反应方向移动 |
关于溶液的下列说法正确的是( )
| A.c(H+):c(OH-)=1:10-2的溶液中K+、Ba2+、ClO-、CO32-一定能大量存在 |
| B.水电离出来的c(H+)=10-13mol/L的溶液中K+、Cl-、NO3-、I-一定能大量存在 |
| C.往0.1mol/LCH3COOH溶液中通人少量HCl,醋酸的电离平衡向逆反应方向移动,且溶液中增大 |
| D.等物质的量浓度的下列溶液:①H2CO3②Na2CO3③NaHCO3④(NH4)2CO3中c(CO32-)的大小关系为:②>④>③>① |
分别在pH=2的酸和pH=12的NaOH溶液中加入足量的铝,放出H2的量前者多,其原因可能是
①两溶液的体积相同,酸是多元强酸 ②两溶液的体积相同,酸是一元弱酸
③酸溶液的体积大于NaOH溶液的体积 ④酸是强酸,浓度比NaOH溶液的大
| A.①② | B.② | C.②③ | D.④ |
在0.1mol/L的醋酸溶液中,存在平衡:CH3COOH CH3COO- +H+下列说法正确的是( )
CH3COO- +H+下列说法正确的是( )
| A.加水稀释,中和此溶液所需的0.1mol/LNaOH溶液的体积增大 |
| B.加入固体碳酸钠,平衡正向移动,c(CH3COOH)减小 |
| C.加入固体醋酸钠,平衡逆向移动,c(H+)、c(CH3COO-)均减小 |
| D.加水稀释,电离程度增大,由CH3COOH电离出来的n(H+)增大 |
往含I-和Cl-的稀溶液中滴入AgNO3溶液,沉淀的质量与加入AgNO3溶液体积的关系如右图所示。则原溶液中c(I-)/c(Cl-)的比值为( )
| A.(V2-V1)/V1 | B.V1/V2 |
| C.V1/(V2-V1) | D.V2/V1 |
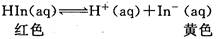
 Ag+(aq)+Cl-(aq),若把AgCl分别放入 ①100mL水中;②50mL0.1mol/L NaCl溶液中;③10mL0.1mol/LAgNO3溶液中;④20mL0.1mol/L MgCl2溶液中。搅拌后在相同的温度下Ag+浓度由大到小的顺序是:
Ag+(aq)+Cl-(aq),若把AgCl分别放入 ①100mL水中;②50mL0.1mol/L NaCl溶液中;③10mL0.1mol/LAgNO3溶液中;④20mL0.1mol/L MgCl2溶液中。搅拌后在相同的温度下Ag+浓度由大到小的顺序是: