题目内容
MnSO4?H2O在工业、农业等方面有广泛的应用.
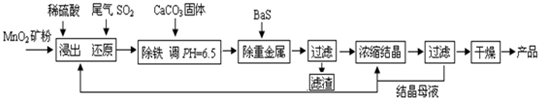
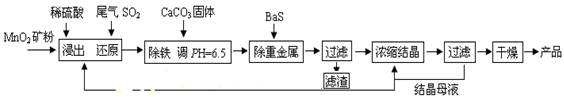
(一)制备:工业上用化工厂尾气中低浓度SO2还原MnO2矿制备MnSO4?H2O过程如下:

已知:常温时部分硫化物难溶盐的Ksp:CuS--6.3×10-36、PbS--1.0×10-28、NiS--2.0×10-26、
MnS--2.5×10-10,请回答下列问题:
(1)生产中MnO2矿粉碎的目的是______.
(2)除铁发生的离子反应方程式为______.
(3)除重金属离子后,若混合溶液中Cu2+、Pb2+、Ni2+的浓度均为1.0×10-5mol/L,则c(S2-)最大=______mol/L.
(二):性质-热稳定性:MnSO4?H2O在1150℃高温下分解的产物是Mn3O4、含硫化合物、水,在该条件下硫酸锰晶体分解反应的化学方程式是______
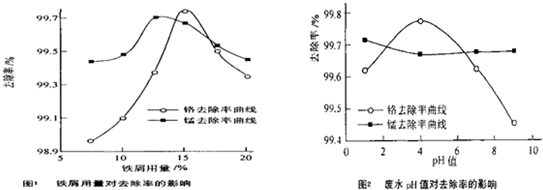
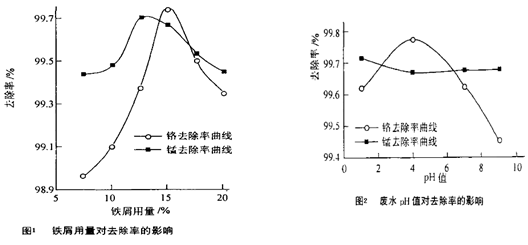
(三)废水处理:工厂废水中主要污染为Mn2+和Cr6+,现研究铁屑用量和pH值对废水中铬、锰去除率的影响,(1)取100mL废水于250mL三角瓶中,调节pH值到规定值,分别加入不同量的废铁屑.得到铁屑用量对铬和锰去除率的影响如下图1所示.则在pH一定时,废水中铁屑用量为______时锰、铬去除率最好
(2)取100mL废水于250mL三角瓶中,加入规定量的铁粉,调成不同的pH值.得到pH值对铬和锰去除率的影响如下图2所示.则在铁屑用量一定时,废水pH=______时锰、铬去除率最好

解:(一)(1)生产中MnO2矿粉碎增大了反应物的接触面积,加快了化学反应速率.
故答案为:增大反应物接触面积,加快反应速率.
(2)溶液中溶解度大的物质向溶解度小的物质转化,碳酸钙的溶度积大于氢氧化铁的溶度积,所以在水溶液里,铁离子和碳酸钙反应生成氢氧化铁,离子方程式为2Fe3++3H2O+3CaCO3=2Fe(OH)3↓+3CO2↑+3Ca2+.
故答案为:2Fe3++3H2O+3CaCO3=2Fe(OH)3↓+3CO2↑+3Ca2+.
(3)当溶液中溶度积最小的物质恰好饱和时硫离子的浓度才最大,溶度积最小的是CuS--6.3×10-36,当溶液中Cu2+为1.0×10-5mol/L,则c(S2-)最大=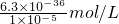 =6.3×10-31 mol/L.
=6.3×10-31 mol/L.
故答案为:6.3×10-31.
(二)MnSO4?H2O在1150℃高温下分解的产物是Mn3O4、含硫化合物、水,生成Mn3O4锰元素失电子,生成二氧化硫是得电子,根据氧化还原反应中得失电子数相等结合原子守恒得出反应方程式为3MnSO4?H2O Mn3O4+SO2↑+2SO3↑+3H2O
Mn3O4+SO2↑+2SO3↑+3H2O
.
故答案为:3MnSO4?H2O Mn3O4+SO2↑+2SO3↑+3H2O.
Mn3O4+SO2↑+2SO3↑+3H2O.
(三)根据图1知,当铁用量逐渐增大时,离子的去除率先增大后减小,当废水中铁屑用量为15%时锰、铬去除率最好.
根据图2知,当溶液的PH值逐渐增大时,锰离子的去除率先减小后增大,铬的去除率先增大后减小,当PH=4时锰、铬去除率最好.
故答案为:15%; 4.
分析:(一)(1)反应物的接触面积越大反应速率越大.
(2)溶液中溶解度大的物质向溶解度小的物质转化,在水溶液里,铁离子和碳酸钙反应生成氢氧化铁.
(3)当溶液中溶度积最小的物质恰好饱和时硫离子的浓度才最大.
(二)根据化学反应中得失电子相等及原子守恒确定反应方程式.
(三)根据图片知,当两种离子的去除率都较大时所对应的PH值和百分量即是.
点评:本题考查了元素化合物的性质、离子方程式和化学反应方程式的书写、图片分析等知识点,难度不大,易错题是(-)中的(3),明确当连溶度积最小的都不产生沉淀时,硫离子的浓度才最大,这样才能作出正确解答.
故答案为:增大反应物接触面积,加快反应速率.
(2)溶液中溶解度大的物质向溶解度小的物质转化,碳酸钙的溶度积大于氢氧化铁的溶度积,所以在水溶液里,铁离子和碳酸钙反应生成氢氧化铁,离子方程式为2Fe3++3H2O+3CaCO3=2Fe(OH)3↓+3CO2↑+3Ca2+.
故答案为:2Fe3++3H2O+3CaCO3=2Fe(OH)3↓+3CO2↑+3Ca2+.
(3)当溶液中溶度积最小的物质恰好饱和时硫离子的浓度才最大,溶度积最小的是CuS--6.3×10-36,当溶液中Cu2+为1.0×10-5mol/L,则c(S2-)最大=
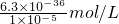 =6.3×10-31 mol/L.
=6.3×10-31 mol/L.故答案为:6.3×10-31.
(二)MnSO4?H2O在1150℃高温下分解的产物是Mn3O4、含硫化合物、水,生成Mn3O4锰元素失电子,生成二氧化硫是得电子,根据氧化还原反应中得失电子数相等结合原子守恒得出反应方程式为3MnSO4?H2O
 Mn3O4+SO2↑+2SO3↑+3H2O
Mn3O4+SO2↑+2SO3↑+3H2O .
故答案为:3MnSO4?H2O
 Mn3O4+SO2↑+2SO3↑+3H2O.
Mn3O4+SO2↑+2SO3↑+3H2O. (三)根据图1知,当铁用量逐渐增大时,离子的去除率先增大后减小,当废水中铁屑用量为15%时锰、铬去除率最好.
根据图2知,当溶液的PH值逐渐增大时,锰离子的去除率先减小后增大,铬的去除率先增大后减小,当PH=4时锰、铬去除率最好.
故答案为:15%; 4.
分析:(一)(1)反应物的接触面积越大反应速率越大.
(2)溶液中溶解度大的物质向溶解度小的物质转化,在水溶液里,铁离子和碳酸钙反应生成氢氧化铁.
(3)当溶液中溶度积最小的物质恰好饱和时硫离子的浓度才最大.
(二)根据化学反应中得失电子相等及原子守恒确定反应方程式.
(三)根据图片知,当两种离子的去除率都较大时所对应的PH值和百分量即是.
点评:本题考查了元素化合物的性质、离子方程式和化学反应方程式的书写、图片分析等知识点,难度不大,易错题是(-)中的(3),明确当连溶度积最小的都不产生沉淀时,硫离子的浓度才最大,这样才能作出正确解答.

练习册系列答案
相关题目
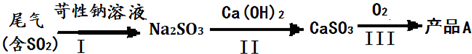

 Fe(OH)3+3H+ 2H++CaCO3=Ca2++CO2↑+H2O
Fe(OH)3+3H+ 2H++CaCO3=Ca2++CO2↑+H2O Mn3O4+SO2↑+2SO3↑+3H2O
Mn3O4+SO2↑+2SO3↑+3H2O