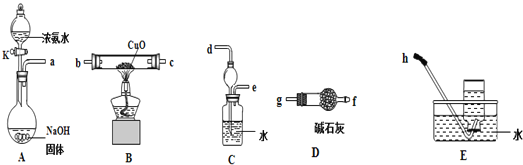
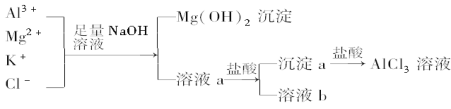
题目内容
【题目】下表是元素周期表的一部分。表中所列的字母分别代表一种化学元素。
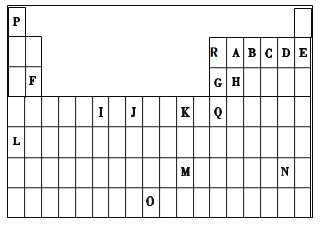
试回答下列问题:
(1)I的最高化合价为__________,J价电子排布图__________。
(2)写出基态时G元素原子中,电子占据的最高能层符号为__________,该能层具有的原子轨道数为____________ 。
(3)第一电离能介于R、B之间的第二周期元素有_____________种。
(4)下列关于元素在元素周期表中的位置以及元素原子的外围电子排布特点的有关叙述不正确的是__________。
a.L位于元素周期表第五周期ⅠA族,属于s区元素
b.O位于元素周期表第七周期Ⅷ族,属于ds区元素
c.M的外围电子排布式为6s1,属于ds区元素
d.H所在族的外围电子排布式为ns2np2,属于p区元素
(5)配合物甲的焰色反应呈紫色,其内界由中心离子J3+与配位体AB-构成,配位数为6,甲的水溶液可用于实验室J2+的定性检验,此方法检验J2+的离子方程式为_____________________。
(6)写出Q元素的简写电子排布式___________________________________。
【答案】 +6 ![]() M 9 3 bc 3Fe2++2[Fe(CN)6]3+=Fe3[Fe(CN)6]2↓ [Ar]3d104s24p1
M 9 3 bc 3Fe2++2[Fe(CN)6]3+=Fe3[Fe(CN)6]2↓ [Ar]3d104s24p1
【解析】考查元素周期表和元素周期律的应用、化学用语,(1)根据周期表,推出I为Cr,价电子排布式为3d54s1,最高价为+6价;J为Mn,Mn的价电子包括最外层和次外层的d能级,因此Mn的价电子排布图为![]() ;(2)G为Al,核外电子排布式为1s12s22p63s23p1,电子占据的最高能层是M,M为第三能层有3个能级,即为s、p、d,含有原子轨道数为9;(3)R为B,B为N,同周期从左向右第一电离能逐渐增大,但IIA>IIIA,VA>VIA,因此符合条件的元素是Be、C、O,有3种元素;(4)a、L为Rb,位于第五周期IA族,属于s能级,故a说法正确;b、O位于元素周期表第七周期Ⅷ族,属于d区,故b说法错误;c、M位于IB族,外围电子不仅指最外层电子,还包括次外层d能级,属于ds区,故c说法错误;d、H位于IVA族,外围电子排布式为ns2np2,属于p区元素,故d说法正确;(5)J为Fe,A为C,B为N,甲的焰色为紫色,说明含有K元素,即甲为K3[Fe(CN)6],与Fe2+反应的离子方程式为3Fe2++2[Fe(CN)6]3+=Fe3[Fe(CN)6]2↓;(6)Q为Ga,简写电子排布式为). [Ar]3d104s24p1。
;(2)G为Al,核外电子排布式为1s12s22p63s23p1,电子占据的最高能层是M,M为第三能层有3个能级,即为s、p、d,含有原子轨道数为9;(3)R为B,B为N,同周期从左向右第一电离能逐渐增大,但IIA>IIIA,VA>VIA,因此符合条件的元素是Be、C、O,有3种元素;(4)a、L为Rb,位于第五周期IA族,属于s能级,故a说法正确;b、O位于元素周期表第七周期Ⅷ族,属于d区,故b说法错误;c、M位于IB族,外围电子不仅指最外层电子,还包括次外层d能级,属于ds区,故c说法错误;d、H位于IVA族,外围电子排布式为ns2np2,属于p区元素,故d说法正确;(5)J为Fe,A为C,B为N,甲的焰色为紫色,说明含有K元素,即甲为K3[Fe(CN)6],与Fe2+反应的离子方程式为3Fe2++2[Fe(CN)6]3+=Fe3[Fe(CN)6]2↓;(6)Q为Ga,简写电子排布式为). [Ar]3d104s24p1。