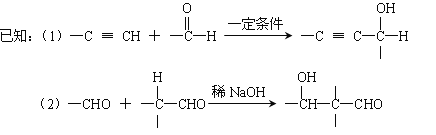
题目内容
【题目】铜的氯化物是重要的化工原料,广泛地用作有机合成催化剂。实验室中以粗铜(含杂质Fe)为原料,某种制备铜的氯化物的流程如下。
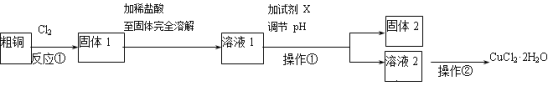
按要求回答下列问题:
(1)在进行操作①之前,要确认溶液中杂质已经完全沉淀,检验的具体操作和现象是 。
(2)上述流程中,所得固体1需要加稀盐酸溶解,其理由是
(3)溶液1可加试剂X用于调节pH以除去杂质,X可选用下列试剂中的(填序号)__________。
a.NaHCO3 b.NH3·H2O c.CuO d.Cu2(OH)2CO3
(4)现用如图所示的实验仪器及药品来制备纯净、干燥的氯气并与粗铜反应(铁架台、铁夹省略)。

①按气流方向连接各仪器接口顺序是:a→ 、 → 、 →f、g→ 。
②为了防止生成氧化铜,实验时在大试管加热前要进行一步重要操作,其操作是 。
③实验过程中,饱和食盐水中出现少许浑浊的现象,请用化学相关原理和知识解释原因: 。
【答案】
(1)充分搅拌,静置;取少许上层清液于试管中再滴加KSCN溶液,若无变化即杂质被完全除掉。(加其他试剂合理也得分,如苯酚)
(2)抑制氯化铜、氯化铁水解; (答“抑制水解”也给分)
(3)cd
(4)①dehib;
②先通入氯气赶走装置中的空气,当试管中充满了黄绿色气体后再加热
③ Na+(aq)+ Cl—(aq)![]() NaCl(s),饱和食盐水吸收HCl气体,使溶液中c(Cl—)增大,平衡向沉淀方向移动。
NaCl(s),饱和食盐水吸收HCl气体,使溶液中c(Cl—)增大,平衡向沉淀方向移动。
【解析】
试题分析:粗铜(含杂质Fe)与氯气反应生成氯化铁和氯化铜,加稀盐酸溶解,形成氯化铁和氯化铜溶液,再加CuO或氢氧化铜等调节pH,使铁离子转化为氢氧化铁沉淀,过滤得到的固体2为氢氧化铁,溶液2为氯化铜溶液,通入二氧化硫,二氧化硫与铜离子发生氧化还原反应生成CuCl,氯化铜溶液在HCl氛围中蒸发结晶得到CuCl22H2O;
(1)在进行操作①之前,要确认溶液中杂质已经完全沉淀,检验的具体操作和现象为充分搅拌,静置;取少许上层清液于试管中再滴加KSCN溶液,若无变化即杂质被完全除掉,故答案为:充分搅拌,静置;取少许上层清液于试管中再滴加KSCN溶液,若无变化即杂质被完全除掉;
(2)氯化铜、氯化铁中的金属离子易水解,直接用水溶液配制溶液会产生浑浊,所以加入过量的酸来溶解氯化铜、氯化铁,以抑制氯化铜、氯化铁水解;故答案为:抑制氯化铜、氯化铁水解;
(3)用于调节pH以除去溶液1杂质可加试剂具有与酸反应,且不引入Cu2+之外的离子,故用CuO或Cu2(OH)或Cu2(OH)2CO3;故答案为:cd;
(4)①仪器连接顺序:Cl2发生装置→除去HCl气体装置→干燥装置→制备装置→多余Cl2处理装置,所以各仪器接口顺序是:a→d、e→h、i→f、g→b,故答案为:dehib;
②为了防止生成氧化铜,实验时在大试管加热前要先通入氯气赶走装置中的空气,当试管中充满了黄绿色气体后再加热,故答案为:先通入氯气赶走装置中的空气,当试管中充满了黄绿色气体后再加热;
③实验过程中,饱和食盐水中存在Na+(aq)+ Cl—(aq)![]() NaCl(s),饱和食盐水吸收HCl气体,使溶液中c(Cl—)增大,平衡向沉淀方向移动,导致出现少许浑浊,故答案为:Na+(aq)+ Cl—(aq)
NaCl(s),饱和食盐水吸收HCl气体,使溶液中c(Cl—)增大,平衡向沉淀方向移动,导致出现少许浑浊,故答案为:Na+(aq)+ Cl—(aq)![]() NaCl(s),饱和食盐水吸收HCl气体,使溶液中c(Cl—)增大,平衡向沉淀方向移动。
NaCl(s),饱和食盐水吸收HCl气体,使溶液中c(Cl—)增大,平衡向沉淀方向移动。

 口算题天天练系列答案
口算题天天练系列答案【题目】下表是元素周期表的一部分,请针对表中所列标号为①~⑩的元素回答下列问题。
族 | IA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
二 | ① | ② | ③ | ④ | ||||
三 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ |
(1)第三周期元素除⑩外原子半径最小的是______(填元素符号),这些元素的最高价氧化物对应水化物中碱性最强的是__________(填化学式,下同),最高价氧化物对应水化物具有两性的是____________,最高价氧化物对应水化物中酸性最强的是__________。
(2)⑥的单质在氯气中燃烧产物的电子式: 。
(3)写出⑦的单质和NaOH溶液反应的化学方程式: 。