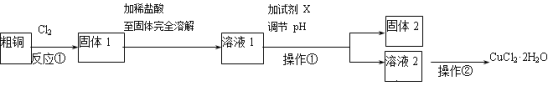
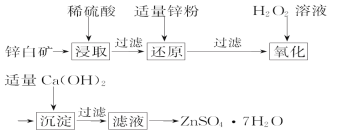
题目内容
【题目】下表是元素周期表的一部分,请针对表中所列标号为①~⑩的元素回答下列问题。
族 | IA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
二 | ① | ② | ③ | ④ | ||||
三 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ |
(1)第三周期元素除⑩外原子半径最小的是______(填元素符号),这些元素的最高价氧化物对应水化物中碱性最强的是__________(填化学式,下同),最高价氧化物对应水化物具有两性的是____________,最高价氧化物对应水化物中酸性最强的是__________。
(2)⑥的单质在氯气中燃烧产物的电子式: 。
(3)写出⑦的单质和NaOH溶液反应的化学方程式: 。
【答案】(1)Cl;NaOH;Al(OH)3;HClO4
(2)![]()
(3)2Al+2NaOH+2H2O=2NaAlO2+3H2↑
【解析】试题分析:根据元素在周期表中的位置知,①~⑩的元素分别是C、N、O、F、Na、Mg、Al、S、Cl、Ar元素。
(1)同一周期元素,原子半径随着原子序数增大而减小,所以第三周期原子半径最小的元素是Cl元素;元素的金属性越强,其最高价氧化物的水化物碱性越强,所以第三周期碱性最强的是NaOH;呈两性的氢氧化物是氢氧化铝,化学式为Al(OH)3;元素的非金属性越强,最高价氧化物对应的水化物酸性越强,所以最高价氧化物对应水化物中酸性最强的是HClO4。
故答案为: Cl;NaOH;Al(OH)3;HClO4;
(2)⑥为镁元素,镁单质在氯气中燃烧生成氯化镁,其电子式为:![]() 。
。
故答案为:![]() ;
;
(3)⑦为铝元素,其单质和NaOH溶液反应的化学方程式为:2Al+2NaOH+2H2O=2NaAlO2+3H2↑。
故答案为:2Al+2NaOH+2H2O=2NaAlO2+3H2↑。

练习册系列答案
相关题目