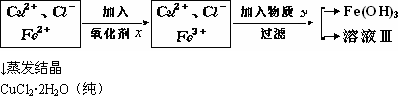
题目内容
(9分) 已知X、Y、Z是阳离子,K是阴离子,M、N是分子。它们都由短周期元素组成,且具有以下结构特征和性质:
①它们的核外电子总数都相同;
②N溶于M中,滴入酚酞,溶液变红;
③Y和K都由A.B两元素组成,Y核内质子数比K多2个;
④X和N都由A、C两元素组成,X和Y核内质子总数相等;
⑤X和K的浓溶液在加热条件下生成M和N;
⑥Z为单核离子,向含有Z的溶液中加入少量含K的溶液,有白色沉淀生成,再加入过量的含K或Y的溶液,沉淀消失。
回答下列问题:
(1)Y的化学式为 ;N的电子式为
(2)试比较M和N的稳定性:M (填“>”或“<”)N。
(3)写出Z和N的水溶液反应的离子方程式: ;
(4))上述六种微粒中的两种可与硫酸根形成一种含三种离子的盐,向该盐的浓溶液中逐滴加入0.1 的NaOH溶液,出现了如图中a、b、c三个阶段的图像,
的NaOH溶液,出现了如图中a、b、c三个阶段的图像,
①写b出阶段的离子方程式:
②根据图像判断该盐的化学式为 。

(1)H3O+
(1分)  (1分) (2)> (1分)
(1分) (2)> (1分)
(3) Al3++3NH3·H2O = Al(OH)3↓+3NH4+ (2分)
(4)①NH4++OH-= NH3·H2O (2分) ②NH4Al(SO4)2 (2分)
【解析】由②可知N是氨气,M是水,即都是10电子微粒。Y核内质子数比K多2个,所以Y是H3O+,K是OH-。X和Y核内质子总数相等,所以X是NH4+,因此A是H,B是O,C是N。根据⑤可知,Z是铝离子。
(1)氨气是含有极性键的共价化合物,电子式为 。
。
(2)非金属性越强,氢化物的稳定性越强,所以水的稳定性强于氨气的。
(3)氢氧化铝是两性氢氧化物,但不溶于氨水中,所以方程式为Al3++3NH3·H2O = Al(OH)3↓+3NH4+。
(4)根据图像中沉淀的变化可知,该沉淀是氢氧化铝,因此含有铝离子。A段表示生成氢氧化铝,b段说明该离子能和氢氧化钠反应,所以应该是NH4+。C段表示氢氧化铝的溶解。根据消耗的氢氧化钠体积可判断,两种阳离子的物质的量是相同的,所以该物质是NH4Al(SO4)2。

 名校课堂系列答案
名校课堂系列答案
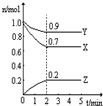
 2Z
2Z