题目内容
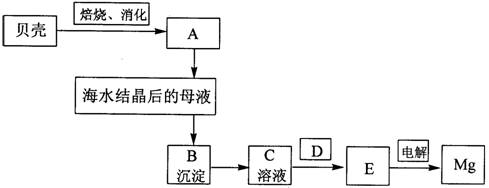
海水是镁的重要来源,从海水中提镁须经过以下流程: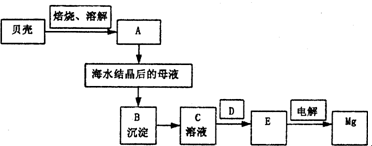
(1)分别写出A、B、C、D、E是什么物质.
A
(2)回答为什么不选择电解MgO制备金属镁.
(3)用电解法制备碱金属、碱土金属时,常常加入CaC12,为什么?
(4)海水结晶后的母液中加入生石灰,请计算溶液中pH=11时,溶液中Mg2+浓度为
(5)我国从20世纪70年代开始采用硅热法炼镁,现年产量已达35.4万吨左右.根据下列条件,完成填空:
Mg(s)+O2(g)=2MgO(s)△H=-601.83kJ/mol
Mg(s)=Mg(g)△H=+150kJ/mol
Si(s)+O2(g)=SiO2(s)△H=-859.4kJ/mol
2MgO(s)+Si(s)=SiO2(s)+2Mg(g)△H=
分析:(1)依据流程图和海水提镁的原理和过程分析判断,贝壳煅烧生成氧化钙,溶于水生成氢氧化钙,加入海水结晶后的母液中测定氢氧化镁,过滤后再沉淀中加入盐酸溶解得到氯化镁溶液,在氯化氢气流中加热析出氯化镁固体,电解法得到镁;
(2)依据氧化镁熔点高难熔融,耗能高,成本高分析;
(3)氯化钙能降低熔融物的熔点降低能耗分析;
(4)依据氢氧化镁存在的沉淀溶解平衡和溶度积常数计算;
(5)依据热化学方程式和盖斯定律计算得到反应焓变.
(2)依据氧化镁熔点高难熔融,耗能高,成本高分析;
(3)氯化钙能降低熔融物的熔点降低能耗分析;
(4)依据氢氧化镁存在的沉淀溶解平衡和溶度积常数计算;
(5)依据热化学方程式和盖斯定律计算得到反应焓变.
解答:解:(1)依据流程图和海水提镁的原理和过程分析判断,贝壳煅烧生成氧化钙,溶于水生成氢氧化钙,加入海水结晶后的母液中测定氢氧化镁,过滤后再沉淀中加入盐酸溶解得到氯化镁溶液,在氯化氢气流中加热析出氯化镁固体,电解法得到镁,所以A为Ca(OH)2,B为Mg(OH)2,C为MgCl2溶液,D为HCl气流,E为MgCl2,
故答案为:Ca(OH)2;Mg(OH)2;MgCl2溶液;HCl气流;MgCl2 ;
(2)依据氧化镁熔点高难熔融,耗能高,成本高分析,氧化镁离子半径小,电荷多,离子键强熔点高,采用氧化镁能效高,对材料的要求高成本高,
故答案为:氧化镁离子半径小,电荷多,离子键强熔点高,采用氧化镁能效高,对材料的要求高成本高;
(3)氯化钙能降低熔融物的熔点降低能耗,用电解法制备碱金属、碱土金属时,常常加入CaC12,氯化钙在电解过程中起到助溶剂的作用,降低 熔点,降低能效,
故答案为:氯化钙在电解过程中起到助溶剂的作用,降低 熔点,降低能效;
(4)依据氢氧化镁存在的沉淀溶解平衡和溶度积常数计算,K sp[Mg(OH)2]=5.6×10-12,溶液中pH=11时c(H+)=10-11mol/L,c(OH-)=10-3mol/L;
得到Ksp=c(Mg2+)×c2(OH-)=5.6×10-12,c(Mg2+)=5.6×10-6mol/L,
故答案为:5.6×10-6;
(5)依据热化学方程式和盖斯定律计算得到反应焓变;
①Mg(s)+O2(g)=2MgO(s)△H=-601.83kJ/mol
②Mg(s)=Mg(g)△H=+150kJ/mol
③Si(s)+O2(g)=SiO2(s)△H=-859.4kJ/mol
依据盖斯定律②×2+③-①得到:2MgO(s)+Si(s)=SiO2(s)+2Mg(g)△H=-107.57kJ/mol,
故答案为:-107.57kJ/mol.
故答案为:Ca(OH)2;Mg(OH)2;MgCl2溶液;HCl气流;MgCl2 ;
(2)依据氧化镁熔点高难熔融,耗能高,成本高分析,氧化镁离子半径小,电荷多,离子键强熔点高,采用氧化镁能效高,对材料的要求高成本高,
故答案为:氧化镁离子半径小,电荷多,离子键强熔点高,采用氧化镁能效高,对材料的要求高成本高;
(3)氯化钙能降低熔融物的熔点降低能耗,用电解法制备碱金属、碱土金属时,常常加入CaC12,氯化钙在电解过程中起到助溶剂的作用,降低 熔点,降低能效,
故答案为:氯化钙在电解过程中起到助溶剂的作用,降低 熔点,降低能效;
(4)依据氢氧化镁存在的沉淀溶解平衡和溶度积常数计算,K sp[Mg(OH)2]=5.6×10-12,溶液中pH=11时c(H+)=10-11mol/L,c(OH-)=10-3mol/L;
得到Ksp=c(Mg2+)×c2(OH-)=5.6×10-12,c(Mg2+)=5.6×10-6mol/L,
故答案为:5.6×10-6;
(5)依据热化学方程式和盖斯定律计算得到反应焓变;
①Mg(s)+O2(g)=2MgO(s)△H=-601.83kJ/mol
②Mg(s)=Mg(g)△H=+150kJ/mol
③Si(s)+O2(g)=SiO2(s)△H=-859.4kJ/mol
依据盖斯定律②×2+③-①得到:2MgO(s)+Si(s)=SiO2(s)+2Mg(g)△H=-107.57kJ/mol,
故答案为:-107.57kJ/mol.
点评:本题考查了生产流程的分析判断,海水制镁的原理应用,溶度积常数计算和盖斯定律计算的分析应用,题目难度中等.

练习册系列答案
 黄冈小状元解决问题天天练系列答案
黄冈小状元解决问题天天练系列答案 三点一测快乐周计划系列答案
三点一测快乐周计划系列答案
相关题目
(10分)(1)写出下列工业生产过程所涉及的主要化学方程式:
①用铝热法炼铁____________________________________________________
②电解法冶炼铝______________________________________________________
③湿法炼铜______________________________________________________
(2)海水中含有氯化镁,是镁的重要来源之一。从海水中制取镁,某同学设计了如下步骤:
①把贝壳制成石灰乳
②直接往海水中加石灰乳,沉降、过滤、洗涤沉淀物
③将沉淀物与盐酸反应,结晶、过滤、干燥产物
④将得到的产物熔融后电解。
下列说法不正确的是__________________(填代号)
| A.此法的优点之一是原料来源丰富 |
| B.进行①②③步骤的目的是从海水中提取氯化镁 |
| C.第④步电解制镁是由于镁是很活泼的金属 |
| D.以上制取镁的过程中涉及的反应有分解反应、化合反应和置换反应 |
。