题目内容
(9分)海水是镁的重要来源,从海水中提镁须经过以下流程:
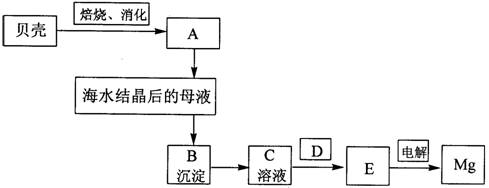
3-1分别写出A、B、C、D、E是什么物质。
3-2回答为什么不选择电解MgO制备金属镁。
3-3用电解法制备碱金属、碱土金属时,常常加入CaC12,为什么?
3-1 A. Ca(OH)2 1分(写成 CaO不给分)
B. Mg(OH)2 1分
C. MgCl2 1分
D. HCl气流 1分
E.无水MgCl2 1分(未写无水不给分)
3-2. 氧化镁离子电荷高、半径小,离子键强,熔点太高(2800℃),如采用氧化镁则能耗高,对材料的要求高,成本提高。 2分
3-3 CaCl2在电解过程中起助溶剂作用,降低熔点,降低能耗。 2分

 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案(14分)镁、铝是两种重要的金属,它们的单质及化合物有着各自的性质。
Ⅰ.海水中含有氯化镁,是镁的重要来源之一。从海水中制取镁,某同学设计了如下
流程步骤: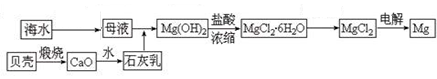
主要的步骤总结如下:①把贝壳制成石灰乳 ②往母液中加石灰乳,沉降、过滤,得到Mg(OH)2沉淀 ③将沉淀物与盐酸反应,结晶、过滤,将制得的晶体脱水得无水MgCl2
④将得到的产物熔融后电解。
(1)下列说法不正确的是__________________(填代号)
| A.此法的优点之一是原料来源丰富 |
| B.进行①②③步骤的目的是从海水中提取氯化镁 |
| C.第④步电解法制取镁是由于镁是很活泼的金属 |
| D.以上制取镁的过程中涉及的反应有分解反应、化合反应和置换反应 |
Ⅱ.(1)铝、空气、海水可组成一种电池,广泛用于制造航标灯。此电池正极的电极反应为 。
(2)铝热还原法是冶炼熔点较高的金属的一种重要方法,焊接钢轨即用到此法。将干燥的氧化铁粉末和铝粉均匀混合后放入纸漏斗中(漏斗已事先处理好),并架在铁架台上,
下面放置一个盛有沙子的蒸发皿。请写出引发铝热反应的操作及该反应的化学方程式:
操作
化学方程式 。
(3)为确定某铝热剂(氧化铁粉末和铝粉)的组成,分别进行下列实验。
若取10.7g样品,向其中加入足量的NaOH溶液,测得生成的气体(标准状况)体积为3.36L,反应的化学方程式为 ,样品中铝的质量是 g。
若取10.7g样品将其点燃,恰好完全反应,待反应产物冷却后,加入足量盐酸,测得生成的气体体积为aL,该气体与上小题中所得气体的体积比等于 ∶ 。
(10分)(1)写出下列工业生产过程所涉及的主要化学方程式:
①用铝热法炼铁____________________________________________________
②电解法冶炼铝______________________________________________________
③湿法炼铜______________________________________________________
(2)海水中含有氯化镁,是镁的重要来源之一。从海水中制取镁,某同学设计了如下步骤:
①把贝壳制成石灰乳
②直接往海水中加石灰乳,沉降、过滤、洗涤沉淀物
③将沉淀物与盐酸反应,结晶、过滤、干燥产物
④将得到的产物熔融后电解。
下列说法不正确的是__________________(填代号)
| A.此法的优点之一是原料来源丰富 |
| B.进行①②③步骤的目的是从海水中提取氯化镁 |
| C.第④步电解制镁是由于镁是很活泼的金属 |
| D.以上制取镁的过程中涉及的反应有分解反应、化合反应和置换反应 |
。