题目内容
2.在水溶液中,YO3n-和S2-发生反应的离子方程式是:YO3n-+3S2-+6H+=Y-+3S+3H2OYO3n-中Y的化合价是+5;若Y为短周期元素,则Y的最高价氧化物是Cl2O7(填化学符号).比较S2-和Y-的还原性:S2->Cl-.S和Y的氢化物中较稳定的是HCl(填化学式).
分析 由反应及电荷守恒可知,n=1,YO3n-中正负化合价的倒数和为-1,Y的最低价为-1价,则最高价为+7价,氧化还原反应中,还原剂的还原性大于还原产物的还原性,以此比较离子的还原性及对应非金属的非金属性,非金属性越强,对应氢化物越稳定.
解答 解:由反应及电荷守恒可知,n=1,YO3n-中正负化合价的倒数和为-1,则YO3n-中Y的化合价是-1-(-2)×3=+5;
Y的最低价为-1价,则最高价为+7价,Y为短周期元素,Y为Cl,则Y的最高价氧化物是Cl2O7,
反应中S元素的化合价升高,Cl元素的化合价降低,由还原剂的还原性大于还原产物的还原性,可知S2-和Y-的还原性为S2->Cl-,则对应非金属的非金属性为Cl>S,非金属性越强,对应氢化物越稳定,则S和Y的氢化物中较稳定的是HCl,
故答案为:+5;Cl2O7;S2->Cl-;HCl.
点评 本题考查氧化还原反应,为高频考点,把握反应中元素的化合价变化为解答的关键,侧重分析与应用能力的考查,注意Y为Cl元素,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
12.能正确表示下列反应的离子方程式是( )
| A. | 浓三氯化铁用于制作印刷线路板:Fe3++Cu═Fe2++Cu2+ | |
| B. | NaHSO4溶液中滴加Ba(OH)2溶液至中性:H++OH-+SO42-+Ba2+═BaSO4↓+H2O | |
| C. | NaHCO3溶液与NaAlO2溶液反应:HCO3-+AlO2-+H2O═Al(OH)3↓+CO2↑ | |
| D. | 向FeCl3溶液中加入Mg(OH)2:3Mg(OH)2+2Fe3+═2Fe(OH)3+3Mg2+ |
13.NA表示阿伏加德罗常数的值,下列说法正确的是( )
| A. | 0.1 mol甲烷含有的电子数为NA | |
| B. | 1 L 0.1 mol/L Na2CO3溶液中含有的CO32-数目为0.1 NA | |
| C. | 1 L pH=1的硫酸溶液中含有的H+数为0.2 NA | |
| D. | 1 mol•L-1 FeCl3溶液中所含Cl-的数目为3NA |
10.强酸和强碱的稀溶液的中和热可表示为:H+(aq)+OH-(aq)═H2O(1)△H═-57.3kJ/mol 已知:
CH3COOH(aq)+NaOH(aq)═CH3COONa(aq)+H2O△H═-Q1kJ/mol
H2SO4(浓)+NaOH(aq)═Na2SO4(aq)+H2O(1)△H═-Q2kJ/mol
HNO3(aq)+KOH(aq)═KNO3(aq)+H2O(1)△H═-Q3kJ/mol
上述反应均为溶液中的反应,则Q1、Q2、Q3的绝对值大小的关系为( )
CH3COOH(aq)+NaOH(aq)═CH3COONa(aq)+H2O△H═-Q1kJ/mol
H2SO4(浓)+NaOH(aq)═Na2SO4(aq)+H2O(1)△H═-Q2kJ/mol
HNO3(aq)+KOH(aq)═KNO3(aq)+H2O(1)△H═-Q3kJ/mol
上述反应均为溶液中的反应,则Q1、Q2、Q3的绝对值大小的关系为( )
| A. | Q1=Q2=Q3 | B. | Q2>Q1>Q3 | C. | Q2>Q3>Q1 | D. | Q2=Q3>Q1 |
17.下列物质的分类正确的一组是( )
| A | B | C | D | |
| 电解质 | NH3 | Na2CO3 | NH4NO3 | Fe(OH)3 |
| 混合物 | 漂白粉 | 明矾 | 水玻璃 | 冰水混合物 |
| 酸性氧化物 | CO2 | NO2 | SiO2 | CO |
| 酸 | HClO | CH3COOH | H2SiO3 | HNO3 |
| A. | A | B. | B | C. | C | D. | D |
7.在无色溶液中能大量共存的是( )
| A. | K+、Ag+、NO3-、Cl- | B. | NH4+、Ba2+、Cl-、CO32- | ||
| C. | Na+、Ca2+、HCO3-、NO3- | D. | K+ Fe3+ Cl- SO42 |
14.金刚石和石墨是碳元素的两种结构不同的单质(同素异形体).在100kPa时,1mol金刚石转化为石墨,会放出1.895kJ的热量.据此,试判断在100kPa压强下,下列结论正确的是( )
| A. | 1mol石墨比1mol金刚石的总能量低 | |
| B. | 1mol石墨比1mol金刚石的总能量高 | |
| C. | 金刚石比石墨稳定 | |
| D. | 无法判断石墨和金刚石的相对稳定性 |
11.有关能量的判断或表示方法正确的是( )
| A. | 由H+(aq)+OH-(aq)═H2O(l)△H=-57.3 kJ•mol-1,可知:含0.5 mol H2SO4的浓溶液与含1 mol NaOH的溶液混合,放出热量大于57.3 kJ | |
| B. | 从C(石墨)═C(金刚石)△H=+1.19 kJ•mol-1,可知:金刚石比石墨更稳定 | |
| C. | 等质量的硫蒸气和硫固体分别完全燃烧,后者放出热量更多 | |
| D. | 2 g H2完全燃烧生成液态水放出285.8 kJ热量,则氢气燃烧的热化学方程式为:2H2(g)+O2(g)═2H2O(l)△H=-285.8 kJ•mol-1 |
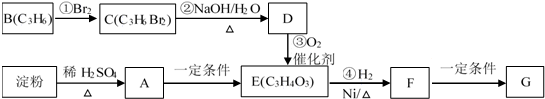
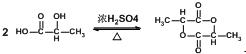 .
.