题目内容
4.若溶液中由水电离产生的c(OH-)=1×10-14mol•L-1,满足此条件的溶液中一定不能大量共存的离子组是( )| A. | Al3+ Na+NO-3 Cl- | B. | K+ Ba2+Cl- NO3- | ||
| C. | K+ Na+ Cl-AlO2- | D. | K+ Fe2+ SO42-NO3- |
分析 由水电离产生的c(OH-)=1×10-14mol•L-1,为酸或碱溶液,根据离子之间不能结合生成沉淀、气体、水等,不能发生氧化还原反应等,则离子大量共存,以此来解答.
解答 解:由水电离产生的c(OH-)=1×10-14mol•L-1,为酸或碱溶液,
A.酸性溶液中该组离子之间不反应,可大量共存,故A不选;
B.酸、碱溶液中该组离子之间不反应,可大量共存,故B不选;
C.碱性溶液中该组离子之间不反应,可大量共存,故C不选;
D.碱性溶液中不能大量存在Fe2+,酸性溶液中H+、Fe2+、NO3-发生氧化还原反应,一定不能大量共存,故D选;
故选D.
点评 本题考查离子的共存,为高频考点,把握习题中的信息及常见离子之间的反应为解答的关键,侧重分析与应用能力的考查,注意离子之间的氧化还原反应等,题目难度不大.

练习册系列答案
相关题目
15.用NA代表阿伏加德罗常数的值,下列说法正确的是( )
| A. | 100 mL1mol/L的FeC13溶液完全生成Fe(OH)3胶体,其胶粒数目为0.1NA | |
| B. | 7.8 gNa2O2中含有的离子总数目为0.4NA | |
| C. | 标准状况下,44.8LHF所含分子数为2NA | |
| D. | 标准状况下,80 gSO3中所含的原子数为4NA |
12.据中央电视台报道,近年来我国的一些沿江城市多次出现大雾天气,致使高速公路关闭,航班停飞,从物质分类来看雾霾属于胶体,它区别于溶液等其它分散系的本质特征是( )
| A. | 是否有丁达尔现象 | B. | 是否均一、透明、稳定 | ||
| C. | 胶体粒子大小在1~100nm之间 | D. | 胶体的分散剂为气体 |
19.甲溶液PH是1,乙溶液PH是2,甲溶液与乙溶液的氢离子浓度之比为( )
| A. | 10﹕1 | B. | 1﹕10 | C. | 2﹕1 | D. | 1﹕2 |
13.已知:HA(aq)+OH-(aq)═A-(aq)+H2O(l)△H=-12.1kJ•mol-1;H+(aq)+OH-(aq)═H2O(l)△H=-55.6kJ•mol-1.则HA在水溶液中的电离反应HA(aq)?H+(aq)+A-(aq)的△H等于( )
| A. | -67.7 kJ•mol-1 | B. | -43.5 kJ•mol-1 | C. | +43.5 kJ•mol-1 | D. | +67.7 kJ•mol-1 |
14.化学科学需要借助化学专用语言描述,下列有关化学用语正确的是( )
| A. | CO2的电子式 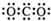 | B. | N2的电子式  | ||
| C. | 乙烯的结构简式 C2H4 | D. | -OH的电子式 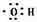 |