题目内容
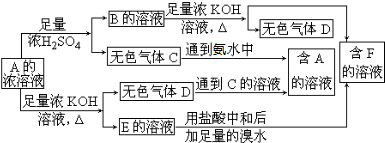
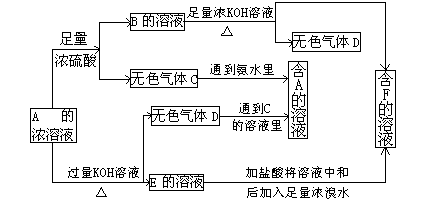
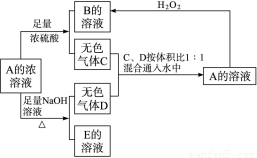
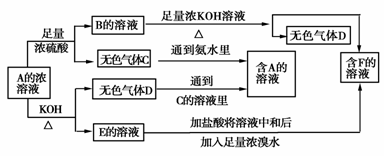
从某物质A的水溶液出发有如图所示的一系列变化:
试回答:
(1)物质的化学式:
A___ _____,
C_____ ___,
E____ ____。
(2)写出E→F的离子方程式:______ _______。
(3)请设计鉴定物质F的实验方案:_____________ ______。
答案:(1)A:(NH4)2SO3或NH4HSO3或二者的混合液;(2分)C:SO2;(2分)E:K2SO3 (2分)(2)SO![]() +Br2+H2O===SO
+Br2+H2O===SO![]() +2Br-+2H+(2分
+2Br-+2H+(2分
(3)可通过焰色反应验出K+,(2分)再用盐酸酸化的BaCl2溶液验出SO![]() 即可。(2分
即可。(2分
解析:这个图示看起来比较复杂,应在阅读时理清顺序,并迅速找出突破点。
B+KOH![]() 气体D,从碱性溶液中逸出的气体比较少,且是加热下才逸出,可初步判定D为NH3,则B及A的溶液中均含有NH
气体D,从碱性溶液中逸出的气体比较少,且是加热下才逸出,可初步判定D为NH3,则B及A的溶液中均含有NH![]() ,判断其阴离子要根据A与足量浓硫酸的反应产生无色气体C和A的浓溶液与KOH共热产生NH3和E的溶液。据图示C气体为酸性气体,且E的溶液含有相应的酸根阴离子,又因为此阴离子与浓H2SO4反应生成气体C,同时该阴离子又可以与浓溴水反应,所以此阴离子中必有SO
,判断其阴离子要根据A与足量浓硫酸的反应产生无色气体C和A的浓溶液与KOH共热产生NH3和E的溶液。据图示C气体为酸性气体,且E的溶液含有相应的酸根阴离子,又因为此阴离子与浓H2SO4反应生成气体C,同时该阴离子又可以与浓溴水反应,所以此阴离子中必有SO![]() 或HSO
或HSO![]() 。
。

练习册系列答案
相关题目