题目内容
15.常温下,下列关于各溶液的叙述中正确的是( )| A. | 三种一元弱酸HX、HY、HZ,其电离平衡常数依次减小,则同体积相同pH的对应钠盐溶液中,阴离子水解能力大小是NaX>NaY>NaZ | |
| B. | 25℃时,pH=12的NaOH溶液与pH=12的氨水中,c(Na+)=c(NH4+) | |
| C. | 浓度分别为0.1mol•L-1和0.01mol•L-1的CH3COOH溶液中c(CH3COO-)前者是后者的10倍 | |
| D. | 向0.01mol•L-1的NH4HSO4溶液中滴加NaOH溶液至中性,则最后所得溶液中c(Na+)=c(SO42-)>C(H+)=c(OH-) |
分析 A、相同温度下,酸的电离平衡常数越小,其相应酸的酸性越弱,相同条件下的钠盐溶液,酸根离子的水解能力越强,其溶液的碱性越强,据此分析;
B、pH相等,说明溶液中氢离子浓度和氢氧根离子浓度相等,据电荷守恒分析;
C、醋酸是弱酸,存在电离平衡,加水稀释醋酸的电离程度增大;
D、溶液至中性,说明c(H+)=c(OH-),据电荷守恒分析.
解答 解:A、相同温度下,酸的电离平衡常数越小,其相应酸的酸性越弱,相同条件下的钠盐溶液,酸根离子的水解能力越强,其溶液的碱性越强,Ka(HX)>Ka(HY)>Ka(HZ),则阴离子水解能力大小顺序是Z->Y->X-,故A错误;
B、据电荷守恒在NaOH溶液中c(Na+)+c(H+)=c(OH-),在氨水中c(NH4+)+c(H+)=c(OH-),pH相等,说明溶液中氢离子浓度和氢氧根离子浓度相等,则c(Na+)=c(NH4+),故B正确;
C、0.01mol•L-1的CH3COOH溶液中醋酸的电离程度大于0.1mol•L-1的醋酸,所以c(CH3COO-)前者比后者的10倍小,故C错误;
D、向0.01mol•L-1的NH4HSO4溶液中滴加NaOH溶液至中性,则最后所得溶液中c(Na+)=2c(SO42-)>C(H+)=c(OH-),故D错误;
故选B.
点评 本题考查了影响弱电解质电离的因素,难度不大,明确哪些物质促进醋酸电离哪些物质抑制其电离即可解答.

练习册系列答案
相关题目
5.下列说法不正确的是( )
| A. | 芳香烃主要来源于煤焦油的分馏和石油的催化重整 | |
| B. | 含苯环的烃都是芳香烃 | |
| C. | 萘(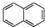 )是苯的同系物 )是苯的同系物 | |
| D. | 乙苯和对二甲苯互为同分异构体 |
3.常温下,下列各组离子在指定溶液中可能大量共存的是( )
| A. | 0.1mol/LNaHSO4溶液中:K+ NH4+ HCO3- NO3- | |
| B. | 与铝反应产生氢气的溶液中:Na+ NH4+ SO42-、F- | |
| C. | 滴加酚酞显红色的溶液中:Na+ NO3- SO42- CO32- | |
| D. | 在pH=2的NaNO3溶液中:Fe2+ K+ Cl- I- |
10.以下反应的反应类型,其中一个不同于其他三个的是( )
| A. | 在光照条件下,甲烷与足量氯气反应生成四氯化碳 | |
| B. | 在溴化铁催化剂作用下,苯与溴反应生成溴苯 | |
| C. | 乙醇在铜或银作催化剂的条件下,与空气中的氧气反应生成乙醛 | |
| D. | 乙酸与乙醇在浓硫酸的作用下生成不溶于水的油状液体 |
20.在标准状况下,如果2.8L氧气含有n个氧原子,则阿伏加德罗常数可表示为( )
| A. | n/8mol-1 | B. | n/16 mol-1 | C. | 8n mol-1 | D. | 4n mol-1 |
7.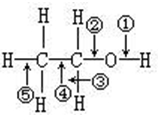 乙醇分子中各种化学键如图所示.下列有关反应断键位置说明错误的是( )
乙醇分子中各种化学键如图所示.下列有关反应断键位置说明错误的是( )
 乙醇分子中各种化学键如图所示.下列有关反应断键位置说明错误的是( )
乙醇分子中各种化学键如图所示.下列有关反应断键位置说明错误的是( )| A. | 乙醇和浓硫酸,共热到140℃时断键①④ | |
| B. | 乙醇和金属钠的反应断键① | |
| C. | 乙醇和浓硫酸,共热到170℃时断键②⑤ | |
| D. | 乙醇在Cu或Ag催化下与O2反应时断键②③ |
4.下列有关溶液组成的描述合理的是( )
| A. | 无色溶液中可能大量存在MnO4-、NH4+、Cl-、S2- | |
| B. | 弱碱性溶液中可能大量存在Na+、K+、NO3-、HCO3- | |
| C. | 酸性溶液中可能大量存在Na+、ClO-、SO42-、I- | |
| D. | 无色溶液中可能大量存在Fe3+、K+、Cl-、SO42- |
5.下列化学用语不正确的是( )
| A. | 乙醇的结构简式为:CH2CH2OH | B. | 乙烯的实验式为:CH2 | ||
| C. | 甲基的电子式为: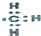 | D. | 三硝基甲苯的结构简式为: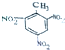 |
 ,B原子L层的电子总数是K层的3倍;0.1mol C单质能从酸中置换出2.24L氢气(标准状况),同时它的电子层结构变成与氖原子的电子层结构相同;D离子的半径比C离子的小,D离子与B离子的电子层结构相同.
,B原子L层的电子总数是K层的3倍;0.1mol C单质能从酸中置换出2.24L氢气(标准状况),同时它的电子层结构变成与氖原子的电子层结构相同;D离子的半径比C离子的小,D离子与B离子的电子层结构相同.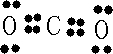 .
.