题目内容
下列说法正确的是( )
| A、其他条件不变加水稀释,醋酸的电离平衡向右移动,醋酸的电离平衡常数增大 | ||
| B、向明矾溶液中逐滴加入Ba(OH)2溶液至Al3+刚好沉淀完全的离子方程式为:Al3++SO42-+Ba2++30H-═BaSO4↓+Al(OH)3↓ | ||
| C、0.2mol?L-1的某一元弱酸HA溶液和0.1mol?L-1 NaOH溶液等体积混合后的溶液:2c(0H-)+c(A-)=2c(H+)+c(HA) | ||
D、已知
|
考点:弱电解质在水溶液中的电离平衡,离子方程式的书写,难溶电解质的溶解平衡及沉淀转化的本质
专题:离子反应专题,电离平衡与溶液的pH专题
分析:A、电离平衡常数只与温度有关,只要温度不变其他条件改变电离平衡常数不变;
B、假设明矾的物质的量为1mol,水溶液中Al3+恰好沉淀时,需氢氧根离子3mol,所以明矾与Ba(OH)2的物质的量之比为1:3,进而书写反应的离子方程式;
C、根据混合后的溶液中电荷守恒和物料守恒进行解答;
D、根据离子的浓度和氢氧根离子浓度,计算出各种离子的离子积,然后根据KSP[Mg(OH)2]=1.8×10-11、KSP[Cd(OH)2]=2.5×10-14进行判断是否生成沉淀.
B、假设明矾的物质的量为1mol,水溶液中Al3+恰好沉淀时,需氢氧根离子3mol,所以明矾与Ba(OH)2的物质的量之比为1:3,进而书写反应的离子方程式;
C、根据混合后的溶液中电荷守恒和物料守恒进行解答;
D、根据离子的浓度和氢氧根离子浓度,计算出各种离子的离子积,然后根据KSP[Mg(OH)2]=1.8×10-11、KSP[Cd(OH)2]=2.5×10-14进行判断是否生成沉淀.
解答:
解:A、中电离平衡常数只与温度有关,只要温度不变其他条件改变电离平衡常数不变,故A错误;
B、假设明矾的物质的量为1mol,水溶液中含1molAl3+,明矾水溶液中Al3+恰好沉淀时,需氢氧根离子3mol,所以明矾与Ba(OH)2的物质的量之比为1:3,正确的离子方程式为:2Al3++3SO42-+3Ba2++6OH-═2Al(OH)3↓+3BaSO4↓,故B错误;
C、根据混合液中电荷守恒可得:c(Na+)+c(H+)=c(A-)+c(OH-),根据物料守恒可得:2c(Na+)=c(A-)+c(HA),两个方程式相结合可得正确关系式为2c(OH-)+c(A-)=2c(H+)+c(HA),故C正确;
D、Kb=
=
,所以c(OH-)=2.2×10-5mol/L,Qc[Mg(OH)2]=0.01mol?L-1×2.2×10-5mol/L×2.2×10-5mol/L=4.84×10-12<1.8×10-11,所以镁离子不沉淀,故D错误;
故选C.
B、假设明矾的物质的量为1mol,水溶液中含1molAl3+,明矾水溶液中Al3+恰好沉淀时,需氢氧根离子3mol,所以明矾与Ba(OH)2的物质的量之比为1:3,正确的离子方程式为:2Al3++3SO42-+3Ba2++6OH-═2Al(OH)3↓+3BaSO4↓,故B错误;
C、根据混合液中电荷守恒可得:c(Na+)+c(H+)=c(A-)+c(OH-),根据物料守恒可得:2c(Na+)=c(A-)+c(HA),两个方程式相结合可得正确关系式为2c(OH-)+c(A-)=2c(H+)+c(HA),故C正确;
D、Kb=
| Kw |
| Ka |
| c(CH3COOH)×c(OH-) |
| c(CH3COO-) |
故选C.
点评:本题考查了溶液中离子浓度大小比较,离子方程式的书写和溶度积的计算的相关知识,明确电荷守恒、盐的水解、物料守恒等在比较溶液中离子浓度大小中的应用方法.

练习册系列答案
相关题目
据报道N5是破坏力极强的炸药之一,18O2比黄金还贵重的物质.下列说法正确的是( )
| A、18O2中含18个中子 |
| B、18O2与16O2性质完全相同 |
| C、N5和N2互为同位素 |
| D、2N5═5N2是化学变化 |
下列叙述正确的是( )
| A、1L 0.1mol/L的碳酸钠溶液中c(Na+):c(CO32-)=2:1 |
| B、25℃时NaOH溶液中水的Kw大于100℃时NaCl溶液中水的Kw |
| C、中和体积相同、pH相等的硫酸和醋酸溶液,消耗等物质的量浓度的NaOH溶液的体积:硫酸>醋酸 |
| D、25℃时,pH=8的0.1mol?L-1 NaX溶液中由水电离出的c(OH-)=1×10-6mol?L-1 |
下列物质中不属于合金的是( )
| A、不锈钢 | B、白铜 |
| C、高碳钢 | D、金刚石 |
下列反应中硝酸既表现氧化性,又表现酸性的是( )
| A、氧化铝和硝酸 |
| B、氧化铜和硝酸 |
| C、硫化氢和硝酸 |
| D、铜和浓硝酸 |
根据酸碱质子理论判定下列说法不正确的是( )
| A、所有的弱酸根都是碱 |
| B、酸式弱酸根既是酸又是碱 |
| C、不可能一种物质既是酸又是碱 |
| D、氢氧根是碱 |
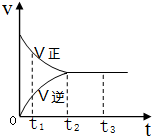 如图是可逆反应X2+3Y2?2Z2 在反应过程中的反应速率V与时间(t)的关系曲线,下列叙述正确的是( )
如图是可逆反应X2+3Y2?2Z2 在反应过程中的反应速率V与时间(t)的关系曲线,下列叙述正确的是( )| A、t1时,只有正方向反应 |
| B、t2时,反应到达限度 |
| C、t2-t3,反应不再发生 |
| D、t2-t3,各物质的浓度不再发生变化 |