题目内容
【题目】用地壳中硅元素生产的多种产品在现代高科技中占重要位置,足见化学对现代物质文明的重要作用.例如:
(1)光导纤维的主要成分是________
(2)目前应用最多的太阳能电池的光电转化材料是________
(3)赏心悦目的雕花玻璃是用一种物质对玻璃进行化学刻蚀而制成的,该反应的化学方程式为________
(4)工业上制取粗硅是用石英和焦炭在高温电炉中反应制得,该反应中氧化剂与还原剂的质量比为 ________;用石英和焦炭在高温电炉中反应也可以制得金刚砂(SiC),并产生CO气体,该反应中氧化剂和还原剂的物质的量之比为________
(5)将表面已氧化的铝箔放入氢氧化钠溶液中,反应的离子方程式分别是________、________
(6)用铝箔包裹0.1mol金属钠,用针扎若干小孔后,放入水中,完全反应后,用排水法收集到标准状况下气体的体积________(填字母序号).
a.等于1.12L b.大于1.12L c.小于1.12L.
【答案】 二氧化硅 硅 SiO2+4HF=SiF4↑+2H2O 5:2 1:2 2Al+2OH﹣+2H2O=2[Al(OH)4]﹣+3H2↑ Al2O3+2OH﹣+3H2O=2[Al(OH)4]﹣ b
【解析】
(1)光导纤维的主要成分是二氧化硅,故答案为:二氧化硅;
(2)晶体硅为良好的半导体材料是目前应用最多的太阳能电池的光电转化材料是硅,故答案为:硅;
(3)玻璃中含有二氧化硅,二氧化硅能够与氢氟酸反应生成四氟化硅和水,化学方程式:SiO2+4HF=SiF4↑+2H2O,故答案为:SiO2+4HF=SiF4↑+2H2O;
(4)SiO2+2C![]() Si+2CO↑反应中,Si元素的化合价降低,C元素的化合价升高,SiO2为氧化剂,C是还原剂,由反应可知,物质的量比为1:2,质量比为1×60:2×12=5:2;SiO2+3C
Si+2CO↑反应中,Si元素的化合价降低,C元素的化合价升高,SiO2为氧化剂,C是还原剂,由反应可知,物质的量比为1:2,质量比为1×60:2×12=5:2;SiO2+3C![]() SiC+2CO↑中,C元素的化合价由0升高为+2价,C元素的化合价由0降低为-4价,则C为氧化剂,也是还原剂,由电子守恒及原子守恒可知,1molC作氧化剂与2molC作还原剂转移电子相等,则氧化剂和还原剂物质的量之比为1:2,故答案为:5:2;1:2;
SiC+2CO↑中,C元素的化合价由0升高为+2价,C元素的化合价由0降低为-4价,则C为氧化剂,也是还原剂,由电子守恒及原子守恒可知,1molC作氧化剂与2molC作还原剂转移电子相等,则氧化剂和还原剂物质的量之比为1:2,故答案为:5:2;1:2;
(5)铝与氢氧化钠反应生成四羟基合铝酸钠和氢气,离子方程式:2Al+2OH-+2H2O=2[Al(OH)4]-+3H2↑;氧化铝与氢氧化钠反应生成四羟基合铝酸钠,离子方程式:Al2O3+2OH-+3H2O=2[Al(OH)4]-,故答案为:2Al+2OH-+2H2O=2[Al(OH)4]-+3H2↑;Al2O3+2OH-+3H2O=2[Al(OH)4]-;
(6)Na和水反应生成NaOH和H2,NaOH和Al反应生成H2和NaAlO2,其方程式为Na+Al+2H2O=NaAlO2+2H2↑,根据方程式知,0.1molNa完全反应生成V(H2)=2n(Na)·Vm=2×0.1mol×22.4L/mol=4.48L>1.12L,故选b。

 阅读快车系列答案
阅读快车系列答案【题目】某研究性学习小组设计实验探究铝等金属的性质:将铝片(不除氧化膜)投入浓氯化铜溶液中,铝表面很快出现一层海绵状暗红色物质,接下来铝片上产生大量气泡.触摸容器知溶液温度迅速上升,收集气体,检验其具有可燃性.若用同样的铝片投入同浓度的硫酸铜溶液中,在短时间内铝片无明显变化.
(1)铝与氯化铜溶液能迅速反应,而与同浓度的硫酸铜溶液在短时间内不反应的原因可能是________.
A.氯化铜溶液酸性比同浓度的硫酸铜溶液酸性强
B.硫酸铜水解生成硫酸使铝钝化
C.氯离子能破坏氧化铝表面薄膜,而硫酸根离子不能
D.生成氯化铝溶于水,而生成硫酸铝不溶于水
请设计一个简单实验验证你的选择:________.
(2)铝片表面出现的暗红色物质的过程中发生的离子反应方程式是________. 用离子方程式解释产生气泡的原因:________.
(3)放出的气体是________,请从有关物质的浓度、能量、是否有电化学作用等分析开始阶段产生气体的速率不断加快的原因是________.(写出一点即可)
(4)某同学通过一定的实验操作,也能使铝片与硫酸铜溶液反应加快,他采取的措施可能是________.
A.用砂纸擦去铝片表面的氧化膜后投入硫酸铜溶液中
B.把铝片投入热氢氧化钠溶液中一段时间后,取出洗涤,再投入硫酸铜溶液中
C.向硫酸铜溶液中滴加氢氧化钠溶液,再投入铝片
D.在铝片上捆上几枚铜钉后投入同浓度的硫酸铜溶液中
(5)除去氧化铝的铝片与铜片为电极,在X电解质溶液中构成原电池,列表如下:
选项 | 铝电极 | 电解质 | 负极反应 | 正极反应 |
A | 正极 | NaOH | Al﹣3e﹣=Al3+ | 2H2O+2e﹣=2OH﹣+H2↑ |
B | 负极 | 稀盐酸 | 2Al﹣6e﹣=2Al3+ | 6H++6e﹣=3H2↑ |
C | 正极 | 浓硝酸 | Cu﹣2e﹣﹣=Cu2+ | 2NO3﹣+4H+﹣4e﹣=2NO2↑+2H2O |
D | 负极 | 稀硝酸 | Cu﹣2e﹣=Cu2+ | 2NO3﹣+8H+=2NO↑+4H2O+6e﹣ |
其中正确的是________,由此推知,金属作电极不仅与本身性质相关,而且与_________有关.
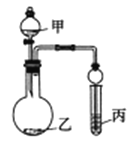
【题目】利用右图所示装置(必要时可加热)进行下列实验,能得出相应实验结论的是
选项 | 甲 | 乙 | 丙 | 实验结论 |
|
A | 苯、液溴 | 铁粉 | AgNO3溶液 | 苯与溴发生取代反应 | |
B | 浓硫酸 | Na2SO3 | 溴水 | SO2具有还原性 | |
C | 浓盐酸 | KMnO4 | 品红溶液 | Cl2具有漂白性 | |
D | 浓氨水 | 碱石灰 | Al2(SO4)3溶液 | Al(OH)3具有两性 |
A. A B. B C. C D. D