题目内容
Zn(OH)2可溶于氨水生成[Zn(NH3)4]2+: Zn(OH)2+4NH3·H2O=Zn(NH3)4]2++4H2O+2OH-
(1)原子序数比Zn元素小1的元素符号为____,该元素原子基态核外电子排布式为______。
(2)NH3、H2O的沸点均高于同族元素氢化物的沸点,是因为________。
(3)NH3中N原子轨道的杂化类型是______。
(4)与H2O分子互为等电子体的分子为_____。
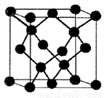
(5)闪锌矿是一种自然界含Zn元素的矿物,其晶体结构属于立方晶体(如右图所示),则在立方ZnS晶体结构中S2-的配位数为________。Zn2+的分数坐标为(l/4,l/4,l/4)、(3/4, 3/4,l/4)、(3/4,l/4,3/4)、(1/4,3/4,3/4),则S2-的分数坐标为______。

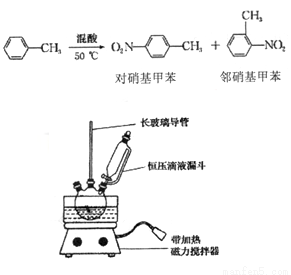
实验室制备一硝基甲笨(主要含邻硝基甲苯和对硝基甲苯)的反应原理、实验装
密度/(g·cm-3) | 沸点/℃ | 式量 | 溶解性 | |
甲苯 | 0.866 | 110.6 | 92 | 不溶于水,易溶于一硝基甲苯 |
对硝基甲苯 | 1.286 | 237.7 | 137 | 不溶于水,易溶于液态烃 |
邻硝基甲苯 | 1.162 | 222 | 137 | 不溶于水,易溶于液态烃 |
实验步骤:
① 配制混酸,组装如图反应装置。取100 mL 烧杯,用10 mL 浓硫酸与30 mL 浓硝酸配
制混酸,加入恒压滴液漏斗中,把15 mL 甲苯(折合质量13.0g)加入三颈烧瓶中。
② 向室温下的甲苯中逐滴加混酸,边滴边搅拌,混合均匀。
③ 在50一60℃ 下发生反应,直至反应结束。
④ 除去混酸后,依次用蒸馏水和10% NaCO3溶液洗涤,最后再用蒸馏水洗涤得到粗产品。
请回答下列问题:
(l)配制40mL 混酸的操作是________________
(2)装置中还缺少__________(填仪器名称)。如果温度超过60℃,将会有____(填物质名称)生成。
(3)分离粗产品和水的操作方法是__________
(4)产品用10% NaCO3溶液洗涤之后,再用蒸馏水洗涤,检验产品是否洗干净的操作是_______
(5)为了得到更纯净的硝基苯,还须先向液体中加入_______除去水,然后蒸馏,若最终得到产品的质量为13.70g,则一硝基甲苯的产率是________。
用如图所示装置和相应试剂能达到实验目的的是
选项 | 实验目的 | 试剂a | 试剂b | 试剂c | 装置 |
A | 验证非金属性:S>C>Si | 稀硫酸 | Na2CO3 | Na2Si03溶液 |
|
B | 制备纯净的氯气 | 浓盐酸 | MnO2 | 饱和食盐水 | |
C | 检验溶液X 中含有CO32- | 盐酸 | 溶液X | 澄清石灰水 | |
D | 除去Na2SO3 中的Na2SO4 | 氯水 | 混合物 | NaOH 溶液 |
A. A B. B C. C D. D


 2NH3是工业上制造氮肥的重要反应。下列关于该反应的说法正确的是
2NH3是工业上制造氮肥的重要反应。下列关于该反应的说法正确的是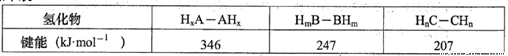

 效成分,I、K可用作食品发泡剂。B是一种有机酸盐,E、F、G均为氧化物,L是红褐色沉淀。
效成分,I、K可用作食品发泡剂。B是一种有机酸盐,E、F、G均为氧化物,L是红褐色沉淀。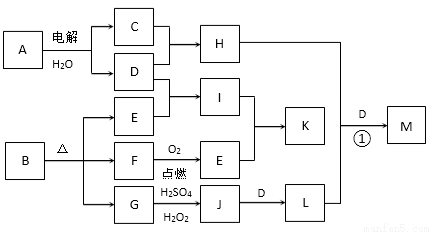
 2NH3(正反应是放热反应).下列有关说法正确的是
2NH3(正反应是放热反应).下列有关说法正确的是 B.
B. 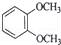 C.
C. 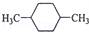 D.
D. 