题目内容
二氧化氯(ClO2)是一种在水处理等方面有广泛应用的高效安全消毒剂.实验室以NH4Cl、盐酸、NaClO2(亚氯酸钠)为原料制备ClO2的流程下如下:
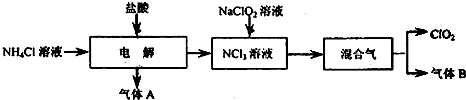
已知:①NCl3是黄色粘稠状液体或斜方形晶体,极易爆炸,有类似氯气的刺激性臭味,自然爆炸点为95℃,在热水中易分解,在空气中易挥发,不稳定.②气体B能使湿润的红色石蕊底纸变蓝.
回答下列问题:
(1)气体A的化学式为 .
(2)电解时,发生反应的化学方程式为 .为保证实验的安全,在电解时需注意的问题是:①控制好生成NCl3的浓度;② .
(3)NCl3与NaClO2(亚氯酸钠)按物质的量之比为1:6混合在溶液中恰好反应生成ClO2,该反应的离子方程式为 .
(4)实验室制取气体B的化学方程式为 .
(5)在用二氧化氯进行水处理时,除了杀菌消毒外,还能除去水中Fe2+和Mn2+.写出用ClO2氧化除去Mn2+生成MnO2的离子方程式(ClO2反应后的产物为ClO-2) .

已知:①NCl3是黄色粘稠状液体或斜方形晶体,极易爆炸,有类似氯气的刺激性臭味,自然爆炸点为95℃,在热水中易分解,在空气中易挥发,不稳定.②气体B能使湿润的红色石蕊底纸变蓝.
回答下列问题:
(1)气体A的化学式为
(2)电解时,发生反应的化学方程式为
(3)NCl3与NaClO2(亚氯酸钠)按物质的量之比为1:6混合在溶液中恰好反应生成ClO2,该反应的离子方程式为
(4)实验室制取气体B的化学方程式为
(5)在用二氧化氯进行水处理时,除了杀菌消毒外,还能除去水中Fe2+和Mn2+.写出用ClO2氧化除去Mn2+生成MnO2的离子方程式(ClO2反应后的产物为ClO-2)
分析:(1)电解NH4Cl、盐酸的溶液,氢离子放电生成氢气;
(2)电解时铵根离子失去电子,氢离子得到电子;结合信息可知NCl3防止分解及爆炸;
(3)NCl3与NaClO2按物质的量之比为1:6恰好反应生成ClO2,还生成氯化钠、NaOH,结合电子守恒可知,Cl元素的化合价升高,则N元素化合价降低,还生成氨气;
(4)由(3)可知,B为氨气,实验室利用铵盐与碱共热生成氨气;
(5)ClO2氧化除去Mn2+生成MnO2,ClO2反应后的产物为ClO-2,以此书写离子方程式.
(2)电解时铵根离子失去电子,氢离子得到电子;结合信息可知NCl3防止分解及爆炸;
(3)NCl3与NaClO2按物质的量之比为1:6恰好反应生成ClO2,还生成氯化钠、NaOH,结合电子守恒可知,Cl元素的化合价升高,则N元素化合价降低,还生成氨气;
(4)由(3)可知,B为氨气,实验室利用铵盐与碱共热生成氨气;
(5)ClO2氧化除去Mn2+生成MnO2,ClO2反应后的产物为ClO-2,以此书写离子方程式.
解答:解:(1)电解NH4Cl、盐酸的溶液,氢离子放电生成氢气,则A为H2,故答案为:H2;
(2)电解时铵根离子失去电子,氢离子得到电子,电解反应为NH4Cl+2HCl
3H2↑+NCl3,结合信息可知NCl3防止分解及爆炸,则还应控制好反应的温度,
故答案为:NH4Cl+2HCl
3H2↑+NCl3;控制好反应的温度;
(3)NCl3与NaClO2按物质的量之比为1:6恰好反应生成ClO2,还生成氯化钠、NaOH,结合电子守恒可知,Cl元素的化合价升高,则N元素化合价降低,还生成氨气,则该反应的离子反应为NCl3+3H2O+6ClO-2=6ClO2↑+3Cl-+3OH-+NH3↑,故答案为:NCl3+3H2O+6ClO-2=6ClO2↑+3Cl-+3OH-+NH3↑;
(4)由(3)可知,B为氨气,实验室利用铵盐与碱共热生成氨气,该反应为2NH4Cl+Ca(OH)2
CaCl2+2NH3↑+2H2O,
故答案为:2NH4Cl+Ca(OH)2
CaCl2+2NH3↑+2H2O;
(5)ClO2氧化除去Mn2+生成MnO2,ClO2反应后的产物为ClO-2,该反应的离子方程式为Mn2++2ClO2+2H2O=MnO2↓+2ClO-2+4H+,
故答案为:Mn2++2ClO2+2H2O=MnO2↓+2ClO-2+4H+.
(2)电解时铵根离子失去电子,氢离子得到电子,电解反应为NH4Cl+2HCl
| ||
故答案为:NH4Cl+2HCl
| ||
(3)NCl3与NaClO2按物质的量之比为1:6恰好反应生成ClO2,还生成氯化钠、NaOH,结合电子守恒可知,Cl元素的化合价升高,则N元素化合价降低,还生成氨气,则该反应的离子反应为NCl3+3H2O+6ClO-2=6ClO2↑+3Cl-+3OH-+NH3↑,故答案为:NCl3+3H2O+6ClO-2=6ClO2↑+3Cl-+3OH-+NH3↑;
(4)由(3)可知,B为氨气,实验室利用铵盐与碱共热生成氨气,该反应为2NH4Cl+Ca(OH)2
| ||
故答案为:2NH4Cl+Ca(OH)2
| ||
(5)ClO2氧化除去Mn2+生成MnO2,ClO2反应后的产物为ClO-2,该反应的离子方程式为Mn2++2ClO2+2H2O=MnO2↓+2ClO-2+4H+,
故答案为:Mn2++2ClO2+2H2O=MnO2↓+2ClO-2+4H+.
点评:本题考查物质的制备,明确流程中发生的电解反应及氧化还原反应是解答本题的关键,题目难度较大,注意信息的应用及流程的分析,(3)为解答的难点.

练习册系列答案
相关题目
 二氧化氯(ClO2)为一种黄绿色气体,是国际上公认的高效、广谱、快速、安全的杀菌消毒剂.
二氧化氯(ClO2)为一种黄绿色气体,是国际上公认的高效、广谱、快速、安全的杀菌消毒剂.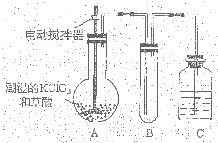 二氧化氯(ClO2)是一种黄绿色有刺激性气味的气体,其熔点为-59℃,沸点为11.0℃,易溶于水.ClO2可以看做是亚氯酸(HClO2)和氯酸(HClO3)的混合酸酐.工业上用稍潮湿的KClO3和草酸(H2C2O4)在60℃时反应制得.某学生拟用下图所示装置模拟工业制取及收集ClO2.(夹持仪器已省略).回答问题:
二氧化氯(ClO2)是一种黄绿色有刺激性气味的气体,其熔点为-59℃,沸点为11.0℃,易溶于水.ClO2可以看做是亚氯酸(HClO2)和氯酸(HClO3)的混合酸酐.工业上用稍潮湿的KClO3和草酸(H2C2O4)在60℃时反应制得.某学生拟用下图所示装置模拟工业制取及收集ClO2.(夹持仪器已省略).回答问题: