题目内容
【题目】海水资源开发利用的部分过程如图所示:
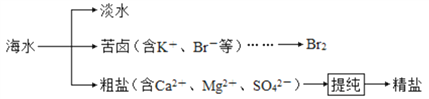
下列说法不正确的是
A. 海水淡化的常用方法有蒸馏法、 电渗析法和离子交换法
B. 可通过分液的方法分离溴单质和苯的混合物
C. 提纯时,所加试剂可依次为 BaCl2、 NaOH、 Na2CO3、盐酸
D. 精盐、 NH3和 CO2是侯德榜制碱工业的主要原料
【答案】B
【解析】A. 海水淡化的常用方法有蒸馏法、 电渗析法和离子交换法,A正确;B. 溴易溶在苯中,不能通过分液的方法分离溴单质和苯的混合物,而是蒸馏,B错误;C. Ca2+用碳酸钠除去,Mg2+用氢氧化钠除去,SO42-用氯化钡除去,最后加入盐酸酸化。但由于过量的氯化钡要用碳酸钠来除,所以碳酸钠必需放在氯化钡的后面,而氢氧化钠可以随意调整,因此提纯”时,所加试剂可依次为 BaCl2、 NaOH、 Na2CO3、盐酸,C正确;D. 精盐、NH3和 CO2是侯德榜制碱工业的主要原料,D正确,答案选B。

 教材全解字词句篇系列答案
教材全解字词句篇系列答案【题目】已知:实验室常用无水乙醇(CH3CH2OH)制备乙烯,制备原理为:CH3CH2OH ![]() CH2=CH2↑+H2O.
CH2=CH2↑+H2O.
无水乙醇性质如表:
物质 | 熔点/℃ | 沸点/℃ | 溶解性 | 挥发性 | 化学性质 |
无水乙醇 | ﹣114.1 | 78.3 | 能与水以任意比互溶 | 易挥发 | 能使酸性高锰酸钾溶液褪色 |
甲、乙同学用下列实验装置制备乙烯并验证其性质.(气密性已检验,部分夹持装置略).
实验操作和现象:
操 作 | 现 象 |
点燃酒精灯,加热至170℃ | I:A中烧瓶内液体渐渐变黑 |
… | |
实验完毕,清洗烧瓶 | III:A中烧瓶内附着少量黑色颗粒状物,有刺激性气味逸出 |
(1)写出乙烯的1个用途: , 对应方程式为(注明反应类型) .
(2)A中烧瓶内溶液“渐渐变黑”,说明浓硫酸具有性.
(3)分析使B中溶液褪色的物质,甲认为是C2H4使B中溶液褪色,该反应的化学方程式为(注明反应类型) .
(4)乙根据反应原理及现象I和III综合分析,认为产物中除乙烯外还混有乙醇、H2O、CO2和一种“有刺激性气味”的气体X.你认为这种“有刺激性气味”气体X是(填化学式).
(5)为验证气体X的存在,并证实是C2H4使B中溶液褪色,乙设计如下装置,与A连接:
设 计 | 现 象 |
与A连接的装置如下: | C中溶液褪色,加热后又恢复红色; |
请回答下列问题:
D中盛放的试剂是(填化学式),不能盛放酸性KMnO4溶液的原因是(用离子方程式解释): .
【题目】下表符号中“2”的含义正确的一组是( )
| 2He | Cl2 | Ca2+ | |
A | 质量数 | 中子数 | 质子数 | 电荷数 |
B | 质量数 | 质子数 | 原子数 | 电荷数 |
C | 质子数 | 中子数 | 原子数 | 电子数 |
D | 质量数 | 质子数 | 分子数 | 电荷数 |
A.A
B.B
C.C
D.D