题目内容
【题目】在一定温度下,二氧化硫与氧气反应的热化学方程式为2SO2(g)+O2(g)![]() 2SO3(g) ΔH=-196 kJ·mol-1。现向5 L的恒容密闭容器中充入1.0 mol SO2和0.5 mol O2气体,反应一段时间后达到平衡,恢复到原温度,测得此过程中体系向外界共释放了78.4 kJ的热量。下列说法正确的是 ( )
2SO3(g) ΔH=-196 kJ·mol-1。现向5 L的恒容密闭容器中充入1.0 mol SO2和0.5 mol O2气体,反应一段时间后达到平衡,恢复到原温度,测得此过程中体系向外界共释放了78.4 kJ的热量。下列说法正确的是 ( )
A. 上述反应达到平衡时,二氧化硫和氧气的转化率都是20%
B. 上述反应达到平衡后,向容器中充入1.0 mol Ar,平衡正向移动
C. 起始时向容器中充入1.0 mol SO3,保持温度不变,达到平衡时共吸收19.6 kJ的热量
D. 起始时向容器中充入2.0 mol SO3、0.5 mol SO2和0.25 mol O2,反应达到平衡前v正<v逆
【答案】C
【解析】设参加反应的二氧化硫和氧气的物质的量分别是xmol、ymol ,
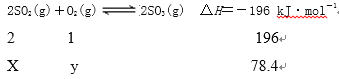
![]() 、
、 ![]() ,x=0.8 y=4 ,二氧化硫的转化率是
,x=0.8 y=4 ,二氧化硫的转化率是![]() ,二氧气的转化率
,二氧气的转化率![]() ,故A错误;向容器中充入1.0 mol Ar,反应物浓度不变,平衡不移动,故B错误;根据等效平衡原理,起始时向容器中充入1.0 mol SO3,保持温度不变,充入1.0 mol SO2和0.5 mol O2气体是等效平衡,达到平衡时二氧化硫的物质的量都是0.2mol,吸收19.6 kJ的热量,故C正确;该反应的动平衡时,含有0.8 mol SO3、0.2 mol SO2和0.1 mol O2,K=
,故A错误;向容器中充入1.0 mol Ar,反应物浓度不变,平衡不移动,故B错误;根据等效平衡原理,起始时向容器中充入1.0 mol SO3,保持温度不变,充入1.0 mol SO2和0.5 mol O2气体是等效平衡,达到平衡时二氧化硫的物质的量都是0.2mol,吸收19.6 kJ的热量,故C正确;该反应的动平衡时,含有0.8 mol SO3、0.2 mol SO2和0.1 mol O2,K=![]() =160 , 起始时向容器中充入2.0 mol SO3、0.5 mol SO2和0.25 mol O2,
=160 , 起始时向容器中充入2.0 mol SO3、0.5 mol SO2和0.25 mol O2,![]() =64,
=64,![]() , v正>v逆,故D错误。
, v正>v逆,故D错误。

练习册系列答案
相关题目