题目内容
过氧化银(Ag2O2)是银锌碱性电池正极的活性物质,可通过下列反应制备:
K2S2O8+2AgNO3+4KOH Ag2O2↓+2KNO3+2K2SO4+2H2O
Ag2O2↓+2KNO3+2K2SO4+2H2O
(1)已知K2S2O8和H2O2含有一个相同的化学键,则该反应________ (填“是”或“不是”)氧化还原反应;已知下列反应:Mn2++S2O82-+H2O→MnO4-+SO42-+H+(未配平),反应中氧化剂与还原剂的物质的量之比为________。
(2)制备Ag2O2的反应进行完全后,经过滤、洗涤、干燥,即可得到Ag2O2,检验Ag2O2是否洗涤干净的方法是________。
(3)一种银锌(Ag2O2、Zn)碱性电池的电解质溶液为KOH溶液,电池放电时正极生成Ag,负极只生成一种化合物(只含有Zn、K、H、O),其中Zn元素的质量分数为30%,钾、锌两种元素的质量比为78?65,则该电池的总反应方程式为________。
(4)用银锌电池电解尿素[CO(NH2)2]的碱性溶液可制取H2,其装置如图所示(电解池中隔膜仅阻止气体通过,M、N均为惰性电极)。
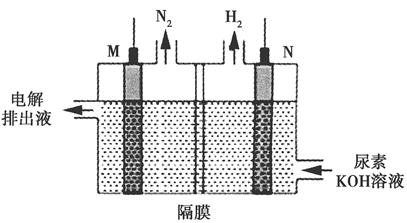
①N极与银锌电池的________(填“Zn”或“Ag2O2”)相连。
②M极的电极反应式为________________________。
K2S2O8+2AgNO3+4KOH
 Ag2O2↓+2KNO3+2K2SO4+2H2O
Ag2O2↓+2KNO3+2K2SO4+2H2O(1)已知K2S2O8和H2O2含有一个相同的化学键,则该反应________ (填“是”或“不是”)氧化还原反应;已知下列反应:Mn2++S2O82-+H2O→MnO4-+SO42-+H+(未配平),反应中氧化剂与还原剂的物质的量之比为________。
(2)制备Ag2O2的反应进行完全后,经过滤、洗涤、干燥,即可得到Ag2O2,检验Ag2O2是否洗涤干净的方法是________。
(3)一种银锌(Ag2O2、Zn)碱性电池的电解质溶液为KOH溶液,电池放电时正极生成Ag,负极只生成一种化合物(只含有Zn、K、H、O),其中Zn元素的质量分数为30%,钾、锌两种元素的质量比为78?65,则该电池的总反应方程式为________。
(4)用银锌电池电解尿素[CO(NH2)2]的碱性溶液可制取H2,其装置如图所示(电解池中隔膜仅阻止气体通过,M、N均为惰性电极)。

①N极与银锌电池的________(填“Zn”或“Ag2O2”)相连。
②M极的电极反应式为________________________。
(1)不是 5?2
(2)取少量最后一次洗涤液,滴加1~2滴硝酸酸化的Ba(NO3)2溶液,若不出现白色浑浊,则表明已洗涤干净
(3)2Zn+Ag2O2+4KOH+2H2O=2K2Zn(OH)4+2Ag
(4)①Zn ②CO(NH2)2+8OH--6e-=CO32-+N2↑+6H2O
(2)取少量最后一次洗涤液,滴加1~2滴硝酸酸化的Ba(NO3)2溶液,若不出现白色浑浊,则表明已洗涤干净
(3)2Zn+Ag2O2+4KOH+2H2O=2K2Zn(OH)4+2Ag
(4)①Zn ②CO(NH2)2+8OH--6e-=CO32-+N2↑+6H2O
(1)根据题意可知,K2S2O8中含有过氧键,而生成物过氧化银中也有过氧键,该反应中各元素化合价没有发生变化,属于非氧化还原反应。Mn2+与S2O82-的反应中,氧化剂是S2O82-,还原剂是Mn2+,根据其化合价变化值可知其物质的量之比为5?2。
(2)根据中学所学知识,检验SO42-即可,但不能使用BaCl2或Ba(OH)2,因为原反应物中含有Ag+。
(3)首先根据题意确定负极产物的化学式,设负极产物的化学式为K2ZnOxHy,则:65/30.8%=211,211-65-78=68,分析讨论得x=y=4成立,故负极产物的化学式为K2Zn(OH)4。结合元素守恒可以写出该电池的总反应式。
(4)①电解时,CO(NH2)2中N元素的化合价升高,发生氧化反应,所以CO(NH2)2在阳极放电,即M是阳极,应与原电池的正极(Ag2O2)相连;N极生成氢气,必然是H+放电,发生还原反应,N是阴极,与原电池的负极(Zn)相连。②根据得失电子守恒、元素守恒和电荷守恒可写出M极的电极反应式。
点拨:不少同学误认为K2S2O8中O为-2价,S为+7价,实际上S的最高正价应该为+6价。
(2)根据中学所学知识,检验SO42-即可,但不能使用BaCl2或Ba(OH)2,因为原反应物中含有Ag+。
(3)首先根据题意确定负极产物的化学式,设负极产物的化学式为K2ZnOxHy,则:65/30.8%=211,211-65-78=68,分析讨论得x=y=4成立,故负极产物的化学式为K2Zn(OH)4。结合元素守恒可以写出该电池的总反应式。
(4)①电解时,CO(NH2)2中N元素的化合价升高,发生氧化反应,所以CO(NH2)2在阳极放电,即M是阳极,应与原电池的正极(Ag2O2)相连;N极生成氢气,必然是H+放电,发生还原反应,N是阴极,与原电池的负极(Zn)相连。②根据得失电子守恒、元素守恒和电荷守恒可写出M极的电极反应式。
点拨:不少同学误认为K2S2O8中O为-2价,S为+7价,实际上S的最高正价应该为+6价。

练习册系列答案
 出彩同步大试卷系列答案
出彩同步大试卷系列答案
相关题目
 2Fe + Al2O3,下列说法中正确的是( )
2Fe + Al2O3,下列说法中正确的是( )