题目内容
在一定温度下,向一个容积为2L的密闭容器内(预先加入催化剂)通入2mol NH3,经过一段时间后,测得容器内的压强为起始时的1.2倍.则NH3的转化率为( )
| A、25% | B、80% |
| C、10% | D、20% |
考点:化学平衡的计算
专题:化学平衡专题
分析:令平衡时参加反应NH3的物质的量为xmol,利用三段式表示出平衡时各组分的物质的量,利用压强之比等于物质的量之比,结合平衡时容器内气体压强为起始时的1.2倍列方程计算x的值,进而计算NH3的转化率.
解答:
解:令平衡时参加反应N2的物质的量为xmol,利用三段式表示出平衡时各组分的物质的量:
2NH3 N2(g)+3H2(g)
N2(g)+3H2(g)
开始(mol):2 0 0
变化(mol):x 0.5x 1.5x
平衡(mol):2-x 0.5x 1.5x
所以2-x+0.5x+1.5x=2×1.2
解得x=0.4,所以NH3的转化率为
×100%=20%
故选D.
2NH3
 N2(g)+3H2(g)
N2(g)+3H2(g)开始(mol):2 0 0
变化(mol):x 0.5x 1.5x
平衡(mol):2-x 0.5x 1.5x
所以2-x+0.5x+1.5x=2×1.2
解得x=0.4,所以NH3的转化率为
| 0.4 |
| 2 |
故选D.
点评:本题考查化学平衡转化率的计算,难度中等,解决此类问题时可以利用化学平衡的三段式进行计算,抓住压强之比等于物质的量之比;

练习册系列答案
 黄冈创优卷系列答案
黄冈创优卷系列答案
相关题目
下列有机物有两种同分异物体的是( )
| A、甲烷的二氯代物 |
| B、二氯苯 |
| C、异丁烷的一氯代物 |
| D、异戊烷的一氯代物 |
下列微粒在水溶液中能大量共存的是( )
| A、Fe3+、H+、I-、Na+ |
| B、Al3+、Na+、AlO2-、SO42- |
| C、K+、NH4+、H+、CO32- |
| D、Cu2+、SO42-、Al3+、Cl- |
相同温度下的0.1mol?L-1 Na2CO3和0.1mol?L-1 NaHCO3溶液的pH,前者和后者的关系是( )
| A、前者大 | B、相等 |
| C、前者小 | D、不能肯定 |
可用Zn+Br2═ZnBr2 设计成蓄电池,其中负极反应是( )
| A、Zn→Zn2++2e- |
| B、Br2+2e-→2Br- |
| C、2Br→Br2+2e- |
| D、Zn2++2e-→Zn |
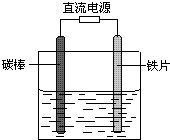 如图所示,电解未精制饱和食盐水(含有少量Mg2+),在碳棒和铁片表面均有气体生成,一段时间后铁片附近出现浑浊现象.下列叙述正确的是( )
如图所示,电解未精制饱和食盐水(含有少量Mg2+),在碳棒和铁片表面均有气体生成,一段时间后铁片附近出现浑浊现象.下列叙述正确的是( )| A、碳棒接直流电源的负极 |
| B、碳棒上发生还原反应 |
| C、铁片上的电极反应式为2Cl--2e-═Cl2↑ |
| D、铁片附近出现的浑浊物是Mg(OH)2 |
两种气态烃组成的混合气体完全燃烧后得到CO2和H2O的物质的量随混合烃的总物质的量的变化如图所示,则下列对混合烃的判断正确的是( )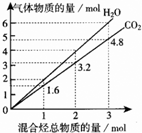
①一定有乙烯;②一定有甲烷;③一定有丙烷;④一定无乙烷;⑤可能有乙烷;⑥可能有丙炔.

①一定有乙烯;②一定有甲烷;③一定有丙烷;④一定无乙烷;⑤可能有乙烷;⑥可能有丙炔.
| A、②③⑤ | B、⑤⑥ |
| C、①② | D、②④⑥ |
下面对数据资料的利用不正确的是( )
| A、利用热效应大小可以判断某些物质的稳定性强弱 |
| B、利用密度数据可判断液体混合物是否可以通过蒸馏分离 |
| C、利用原子(或离子)半径数据可推断某些原子(或离子)的氧化性和还原性的强弱 |
| D、利用溶解度数据可推测将一些物质混合物分离开来的可能性 |
H2CO3和H2S在25℃时的电离常数如下:则下列反应可能发生的是( )
| 电离常数 | K1 | K2 |
| H2CO3 | 4.2×10-7 | 5.6×10-11 |
| H2S | 5.7×10-8 | 1.2×10-15 |
| A、NaHCO3+NaHS=Na2CO3+H2S |
| B、H2S+2Na2CO3=Na2S+2NaHCO3 |
| C、Na2S+H2O+CO2=NaHS+NaHCO3 |
| D、H2S+NaHCO3=NaHS+H2CO3 |