题目内容
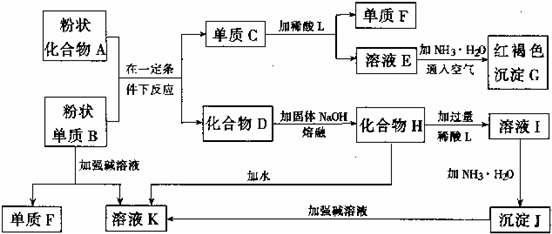
根据以下化学反应框图完成下列问题: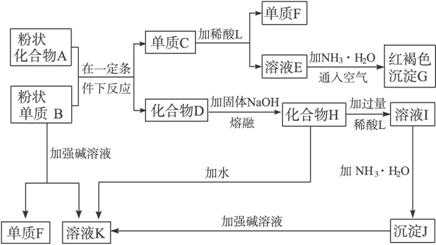
(1)单质F是_____________。
(2)写出由E生成G的离子反应方程式(或化学方程式)__________________________。
(3)溶液Ⅰ中所含金属离子是_____________。
(4)由C→E+F若改用浓酸,则不能用的浓酸是(写分子式)_____________。
(1)H2
(2)Fe2++2NH3·H2O====Fe(OH)2↓+2![]()
4Fe(OH)2+O2+2H2O====4Fe(OH)3↓或4Fe2++8NH3·H2O+O2+2H2O====4Fe(OH)3↓+8![]()
(3)Na+、Al3+
(4)H2SO4(浓)、HNO3(浓)
解析:加入NH3·H2O并通入空气得到红褐色沉淀G,G应是Fe(OH)3,这是解答该题的突破口,E溶液中应含Fe2+。单质C与稀酸反应得到单质F和含Fe2+的溶液E,C应是Fe,单质F应是H2。化合物D可与熔融烧碱反应,由已知可得D应是金属氧化物。单质B可从化合物A中置换出Fe,B一定是金属;该金属又能与强碱溶液反应生成H2,B一定是Al。溶液K应含NaAlO2。由此可确定D是Al2O3,H是NaAlO2。NaAlO2与过量稀酸反应后的溶液I中,金属离子只能是Na+与Al3+。向I溶液中加入NH3·H2O得到Al(OH)3沉淀(J)。向Al(OH)3沉淀中加强碱溶液、向NaAlO2(H)中加水都得到NaAlO2溶液(K),可作为以上推断的验证。C→E+F即Fe→H2↑+Fe2+,当然不能使用强氧化性酸,否则Fe2+会被氧化成Fe3+。

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目