题目内容
铅蓄电池在人们的日常生活中的应用很广泛.构成铅蓄电池的两极分别为Pb、PbO2,电解质为硫酸溶液,反应方程式为Pb+PbO2+2H2SO4
2PbSO4+2H2O.以下说法中不正确的是( )
| 放电 |
| 充电 |
| A、放电时,Pb为负极,被氧化 |
| B、充电时,PbO2为阴极,被还原 |
| C、充电时,溶液的pH不断减小 |
| D、若放电过程中转移了0.4mol电子,则消耗Pb的质量为41.4g |
考点:常见化学电源的种类及其工作原理
专题:电化学专题
分析:根据电池反应式知,放电时,铅失电子发生氧化反应而作负极,电极反应式为Pb-2e-+SO42-=PbSO4,二氧化铅得电子作正极,电极反应式为PbO2+SO42-+2e-+4H+═PbSO4+2H2O,电子从负极沿外电路流向正极,溶液中氢离子参加反应而导致溶液中氢离子浓度逐渐减小,电解质溶液中阳离子向正极移动,阴离子向负极移动.
解答:
解:A.根据元素化合价变化知,铅失电子作还原剂而被氧化,则铅作负极,故A正确;
B.硫酸铅变成二氧化铅失电子作阳极,被氧化,故B错误;
C.由方程式可知,充电时,消耗水,生成硫酸,电解质溶液中硫酸浓度增大,溶液的pH不断减小,故C正确;
D.若放电过程中转移了0.4mol电子,消耗0.2mol的铅,则消耗Pb的质量为41.4g,故D正确;
故选B.
B.硫酸铅变成二氧化铅失电子作阳极,被氧化,故B错误;
C.由方程式可知,充电时,消耗水,生成硫酸,电解质溶液中硫酸浓度增大,溶液的pH不断减小,故C正确;
D.若放电过程中转移了0.4mol电子,消耗0.2mol的铅,则消耗Pb的质量为41.4g,故D正确;
故选B.
点评:本题考查了电化学的相关知识,根据元素化合价变化确定电极,再结合阴阳离子的移动方向、氢离子浓度的变化来分析解答,难度中等.

练习册系列答案
相关题目
下列说法正确的是( )
| A、常温常压下,8克O3含有0.5NA个氧原子(相对原子质量O:16) |
| B、1mol?L-1的Ca(ClO)2溶液中含ClO-数目为2NA |
| C、标准状况下,22.4L HCl溶于1L水中所得的盐酸含有NA个HCl分子 |
| D、1mol Na被完全氧化生成Na2O2,失去2NA个电子 |
已知C-C单键可以绕键轴旋转,其结构简式可表示为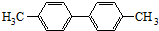 的烃,下列说法中不正确的是( )
的烃,下列说法中不正确的是( )
 的烃,下列说法中不正确的是( )
的烃,下列说法中不正确的是( )| A、该烃是苯的同系物 |
| B、该烃的一氯代物最多有3种 |
| C、分子中至少有8个碳原子处于同一平面上 |
| D、2mol该化合物完全燃烧消耗35mol O2 |
下列化学方程式正确的是( )
| A、CH3COONa+CO2+H2O→CH3COOH+NaHCO3 |
B、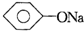 +CO2+H2O→ +CO2+H2O→ +NaHCO3 +NaHCO3 |
C、2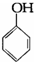 +3Br2→ +3Br2→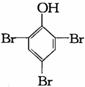 ↓ ↓ |
D、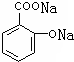 +2CO2+2H2O→ +2CO2+2H2O→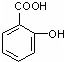 +2NaHCO3 +2NaHCO3 |
下列物质既能使溴水褪色,又能使酸性高锰酸钾溶液褪色的是( )
| A、CH4 |
| B、C2H4 |
| C、C6H6 |
| D、C3H8 |
某种有机物如图所示,有关该物质的说法正确的是( )
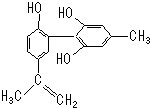

| A、由于酚酸性比碳酸弱,故此物质不可能与碳酸钠溶液反应 |
| B、滴入KMnO4(H+)溶液,观察紫色褪去,能证明结构中存在碳碳双键 |
| C、1mol该物质与浓溴水和H2反应最多消耗Br2和H2分别为4mol、7mol |
| D、该分子中的所有原子可能共平面 |
按图装置进行实验,下列描述正确的是(N装置中两个电极均为石墨棒)( )
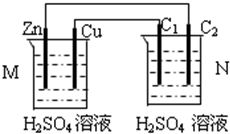

| A、C1上发生还原反应 |
| B、M装置中SO42-移向Cu电极 |
| C、工作一段时间后装置M、N中溶液PH均变大 |
| D、Cu电极与C2电极上的电极反应相同 |
下列各组物质变化时,所克服的微粒间的相互作用或作用力属同种类型的是( )
| A、碘的升华和NH4Cl的“升华” |
| B、冰的融化和石英的熔化 |
| C、NaCl熔化和NaOH溶于水 |
| D、溴的挥发和NH4HCO3的分解 |
下列物质属于纯净物的是( )
| A、空气 | B、碱石灰 | C、液氯 | D、海水 |