题目内容
(2012?潍坊一模)硝酸铜是一种重要的工业产品,化学上有很多方法可以制取硝酸铜:①将铜溶于硝酸中 ②先将铜与O2反应生成CuO,再溶于硝酸中 ③将铜溶于N2O4的乙酸乙酯(溶剂,不参加反应)溶液中生成硝酸铜和一氧化氮.下列认识或判断错误的是( )
分析:A、根据方法③反应产物进行分析;
B、铜与浓硝酸反应为 Cu+4HNO3═Cu(NO3)2+2NO2↑+2H2O,与稀硝酸反应方程式为3Cu+8HNO3═3Cu(NO3)2+2NO↑+4H2O,根据反应方程式分析;
C、方法②铜与氧气反应需要加热,但是反应生成产物无污染;
D、根据生成产物硝酸铜和一氧化氮中的氮元素化合价进行分析.
B、铜与浓硝酸反应为 Cu+4HNO3═Cu(NO3)2+2NO2↑+2H2O,与稀硝酸反应方程式为3Cu+8HNO3═3Cu(NO3)2+2NO↑+4H2O,根据反应方程式分析;
C、方法②铜与氧气反应需要加热,但是反应生成产物无污染;
D、根据生成产物硝酸铜和一氧化氮中的氮元素化合价进行分析.
解答:解:A、方法③反应产物有一氧化氮生成,一氧化氮属于氮气污染物,不如方法②,反应中物污染物产生,故A错误;
B、根据反应方程式:铜与浓硝酸Cu+4HNO3═Cu(NO3)2+2NO2↑+2H2O,铜与稀硝酸3Cu+8HNO3═3Cu(NO3)2+2NO↑+4H2O,可见稀硝酸等量的硝酸铜,稀硝酸消耗的物质的量少,产生的污染气体少,所以用稀硝酸比用浓硝酸好,故B正确;
C、②先将铜与O2反应生成CuO,再溶于硝酸中,铜与氧气反应需要加热才能进行,会消耗能量,但是反应产物是硝酸铜和水,对环境不产生污染,故C正确;
D、方法③中,N2O4与铜反应生成了硝酸根离子和一氧化氮,化合价既有升高又有降低,所以反应中既是氧化剂,也是还原剂,故D正确;
故选:A.
B、根据反应方程式:铜与浓硝酸Cu+4HNO3═Cu(NO3)2+2NO2↑+2H2O,铜与稀硝酸3Cu+8HNO3═3Cu(NO3)2+2NO↑+4H2O,可见稀硝酸等量的硝酸铜,稀硝酸消耗的物质的量少,产生的污染气体少,所以用稀硝酸比用浓硝酸好,故B正确;
C、②先将铜与O2反应生成CuO,再溶于硝酸中,铜与氧气反应需要加热才能进行,会消耗能量,但是反应产物是硝酸铜和水,对环境不产生污染,故C正确;
D、方法③中,N2O4与铜反应生成了硝酸根离子和一氧化氮,化合价既有升高又有降低,所以反应中既是氧化剂,也是还原剂,故D正确;
故选:A.
点评:本题考查了制取硝酸铜的实验方案的设计,关键合理分析题中提供的三种方案,对每个方案从经济及环保方面作出合理评价,充分考查了学生的分析、理解能力,本题难度中等.

练习册系列答案
相关题目
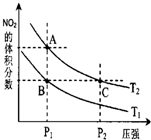 (2012?潍坊一模)反应N2O4(g)?2NO2(g)△H=57kJ?mol-1,在温度为T1、T2时,平衡体系中NO2的体积分数随压强的变化曲线如图所示.下列说法正确的是( )
(2012?潍坊一模)反应N2O4(g)?2NO2(g)△H=57kJ?mol-1,在温度为T1、T2时,平衡体系中NO2的体积分数随压强的变化曲线如图所示.下列说法正确的是( ) ,
,