��Ŀ����
����Ŀ�������ǵ绯ѧԭ����Ӧ�����⡣
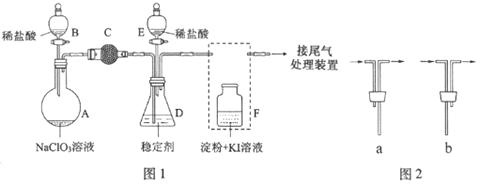
��1����A��B��C��D���ֽ������±�װ��ͼ����ʵ�飮
����ʵ������ش��������⣺���ֽ��������ǿ������˳������ ��
��2������ȼ�ϵ���Ƿ�����ɫ��ѧ��������ͷ���װ�á���ͼΪ���ʾ��ͼ��
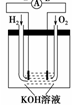
��ش�
������ȼ�ϵ�ص�����ת������Ҫ��ʽ����__________________��
�ڵ����е�����������Ϊ__________(��a��b��ʾ)��
��������ӦʽΪ____________________________��
��3����ͼ�е缫a��b�ֱ�ΪAg�缫��Pt�缫���缫c��d����ʯī�缫��ͨ��һ��ʱ�����c��d�����Ϲ��ռ���336mL����״�������壮�ش�
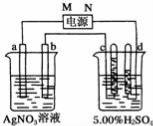
��ֱ����Դ�У�MΪ����������������
��AgNO3��Һ��Ũ�ȣ���������������С����������������ͬ����������
H2SO4��Һ��Ũ����������������
����ʱ��·��ת�Ƶ��ӵ����ʵ���Ϊ____________mol��
���𰸡���1��D��A��B��C
��2������ѧ��ת��Ϊ���� ��a��b
��2H2��4OH����4e��=4H2O(��H2��2OH����2e��=2H2O)
��3������ �����䡢��� 0.02
��������
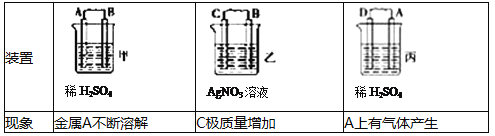
�����������1����ԭ����нϻ��õĽ�����������ʧȥ���ӣ�����������Ӧ������A�����ܽ⣬A�Ǹ�����������A>B��C���������ӣ�C������������C��������������B>C��A�������������A��������������D>A�����Ի�����D��A��B��C��(2)������ȼ�ϵ�ص�����ת������Ҫ��ʽ���ɻ�ѧ��ת��Ϊ���ܣ�ȼ�ϵ���У���������������Ӧ��ͨ��ȼ�������ĵ缫�Ǹ������ڵ����е�����������Ϊ��a��b������������ʧ���ӵ�������Ӧ����2H2+4OH--4e-�T4H2O��H2+2OH--2e-�T2H2O����3������������֪���缫a��b��û���������ɣ���a��������bΪ����������M��ԭ�����������
���ڲ��缫�϶���ʱ�������ϵĵ缫��ӦʽΪAg-e-=Ag+�������ϵĵ缫��ӦʽΪAg++e-=Ag��������������Һ��Ũ�Ȳ��䣻���ϡ������Һʱ����������2H++2e-�TH2������������4OH--4e-�TO2��+2H2O��ʵ���ϵ�����ˮ����Һ�е����ʲ��䣬�ܼ����٣�����ϡ�����Ũ������
�����ϡ���ᷴӦʱ����ͨ��һ��ʱ���c��d�������ռ���336mL���壨��״����������������2H++2e-�TH2������������4OH--4e-�TO2��+2H2O��ʵ���ϵ�����ˮ����ط�ӦʽΪ��2H2O ![]() 2H2��+O2�������ݷ���ʽ֪���������������ռ�������
2H2��+O2�������ݷ���ʽ֪���������������ռ�������![]() �����Ի�������������������224mL������2H++2e-�TH2�� ֪��ת�Ƶ��ӵ����ʵ�����0.02mol����
�����Ի�������������������224mL������2H++2e-�TH2�� ֪��ת�Ƶ��ӵ����ʵ�����0.02mol����