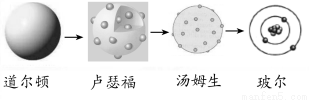
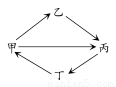
جâؤ؟ؤعبف
A،¢B،¢C،¢D،¢Eتاش×سذٍتزہ´خشِ´َµؤخهضض¶جضـئعشھثط،£Aش×سµؤµç×س²متسëثüµؤ؛ثحâµç×س×ـتدàح¬£¬AسëC،¢BسëD·ض±ًح¬ض÷×ه£¬B؛حCµؤ×îحâ²مµç×ستض®؛حسëEµؤ×îحâ²مµç×ستدàح¬،£AسëEذخ³ةµؤ»¯؛دخﻯر§ت½خھAE£¬ئن·ض×سضذ؛¬18¸ِµç×س،£اë»ط´ًدآءذختجâ£؛
(1)Aشھثطµ¥ضتµؤ»¯ر§ت½خھ________£¬Dشھثطµؤش×س½ل¹¹ت¾زâح¼خھ_______،£
(2)سةA،¢B،¢Cبضضشھثطذخ³ةµؤ»¯؛دخïµؤµç×ست½خھ________£¬صâضض»¯؛دخïذخ³ةµؤ¾§جهضذثù؛¬µؤ»¯ر§¼üہàذحسذ________،£
(3)A،¢B،¢Dبضضشھثطذخ³ةµؤز»ضض»¯؛دخï؛حA،¢Bذخ³ةµؤز»ضض»¯؛دخïؤـ·¢ةْرُ»¯»¹ش·´س¦£¬·´س¦µؤ»¯ر§·½³جت½خھ__________________،£
(4)B،¢C،¢Eبضضشھثطذخ³ةز»ضضرخ£¬´ثرخضذبضضش×سµؤ¸ِت±بخھ1£؛1£؛1£¬شع25،وت±£¬½«¸أرخبـسعث®£¬²âµأبـز؛pH>7£¬ہيسةتا________(سأہë×س·½³جت½±يت¾)،£
(1)H2£»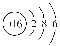 ،،(2)
،،(2) 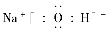 £»ہë×س¼ü،¢¹²¼غ¼ü،،(3)H2SO3£«H2O2=H2SO4£«H2O،،(4)ClO££«H2O
£»ہë×س¼ü،¢¹²¼غ¼ü،،(3)H2SO3£«H2O2=H2SO4£«H2O،،(4)ClO££«H2O HClO£«OH£
HClO£«OH£
،¾½âخِ،؟زہ¾فA،¢B،¢C،¢D،¢Eشھثطµؤذإد¢£¬؟ةحئµ¼³ِAخھا⣬Bخھرُ£¬Cخھؤئ£¬Dخھءٍ£¬Eخھآب£¬شٍA،¢B،¢Cذخ³ةNaOH£¬ئنµç×ست½خھ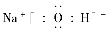 £¬ئنضذ؛¬ہë×س¼ü،¢¹²¼غ¼ü£»HسëOذخ³ةµؤH2O2؛حH،¢O،¢Sذخ³ةµؤH2SO3ؤـ¹»·¢ةْرُ»¯»¹ش·´س¦£¬»¯ر§·½³جت½خھH2O2£«H2SO3=H2SO4£«H2O،£B،¢C،¢Eذخ³ةNaClO£¬ئنبـسعث®زٍClO£ث®½âClO££«H2O??HClO£«OH£¶ّت¹بـز؛³ت¼îذش،£
£¬ئنضذ؛¬ہë×س¼ü،¢¹²¼غ¼ü£»HسëOذخ³ةµؤH2O2؛حH،¢O،¢Sذخ³ةµؤH2SO3ؤـ¹»·¢ةْرُ»¯»¹ش·´س¦£¬»¯ر§·½³جت½خھH2O2£«H2SO3=H2SO4£«H2O،£B،¢C،¢Eذخ³ةNaClO£¬ئنبـسعث®زٍClO£ث®½âClO££«H2O??HClO£«OH£¶ّت¹بـز؛³ت¼îذش،£

 ½ًش؟³×تش¾يدµءذ´ً°¸
½ًش؟³×تش¾يدµءذ´ً°¸خآ¶بخھTت±£¬دٍ2.0 L؛مبفأـ±صبفئ÷ضذ³نبë1.0 mol PCl5£¬·´س¦PCl5(g)£½PCl3(g)£«Cl2(g)¾¹ز»¶خت±¼ن؛َ´ïµ½ئ½؛â،£·´س¦¹³جضذ²â¶¨µؤ²؟·ضت¾ف¼ûدآ±ي£؛
t/s | 0 | 50 | 150 | 250 | 350 |
n(PCl3)/mol | 0 | 0.16 | 0.19 | 0.20 | 0.20 |
دآءذثµ·¨صب·µؤتا(،،،،)
A£®·´س¦شعا°50 s µؤئ½¾ùثظآتv(PCl3)£½ 0.0032 mol،¤L£1،¤s£1
B£®±£³ضئنثûجُ¼²»±ن£¬ة¸كخآ¶ب£¬ئ½؛âت±c(PCl3)£½ 0.11 mol،¤L£1£¬شٍ·´س¦µؤ¦¤H<0
C£®دàح¬خآ¶بدآ£¬ئًت¼ت±دٍبفئ÷ضذ³نبë1.0 mol PCl5،¢0.20 mol PCl3 ؛ح0.20 mol Cl2£¬·´س¦´ïµ½ئ½؛âا°v(ص)>v(ؤو)
D£®دàح¬خآ¶بدآ£¬ئًت¼ت±دٍبفئ÷ضذ³نبë2.0 mol PCl3 ؛ح2.0 mol Cl2£¬´ïµ½ئ½؛âت±£¬PCl3 µؤ×ھ»¯آت´َسع80%
ضذ»ھةجخٌحّر¶£؛2011ؤêضذ¹ْ½«³¬±±أہ³ةخھب«اٍز؛¾§دشت¾ئ÷µع¶´َتذ³،،£ةْ²ْز؛¾§دشت¾ئ÷µؤ¹³جضذت¹سأµؤ»¯ر§اهد´¼ءNF3تاز»ضضخآتزئّجه£¬ئن´و´¢ؤـء؟µؤؤـء¦تاCO2µؤ12000،«20000±¶£¬شع´َئّضذµؤتظأü؟ة³¤´ï740ؤ꣬زشدآتا¼¸ضض»¯ر§¼üµؤ¼üؤـ£؛
»¯ر§¼ü | N،شN | F،ھF | N،ھF |
¼üؤـ/(kJ،¤mol£1) | 941.7 | 154.8 | 283.0 |
دآءذثµ·¨ضذصب·µؤتا(،،،،)
A£®¹³جN2(g)،ْ2N(g)·إ³ِؤـء؟
B£®¹³جN(g)£«3F(g)،ْNF3(g)·إ³ِؤـء؟
C£®·´س¦N2(g)£«3F2(g)،ْ2NF3(g)µؤ¦¤H>0
D£®NF3خüتصؤـء؟؛َبç¹ûأ»سذ»¯ر§¼üµؤ¶دءرسëةْ³ة£¬بش؟ةؤـ·¢ةْ»¯ر§·´س¦