题目内容
【题目】铬及其化合物在材料、颜料及超导等方面用途非常广泛。回答下列问题:
(1)基态Cr原子的价电子排布式为__;Cr成为阳离子时首先失去__轨道的电子。
(2)铬与钾均位于第四周期,铬的熔点和沸点均比钾的高,这是因为__。
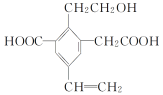
(3)甘氨酸铬(结构如图)是一种配合物,其配位原子是__。

(4)反应:6KSCN+13K2Cr2O7+55H2SO4=13Cr2(SO4)3+6SO2↑+6CO2↑+16K2SO4+55H2O
①KSCN的四种组成元素中第一电离能最大的是__(填元素符号);KSCN中阴离子的空间构型为___形,中心原子的杂化方式是__。
②分子中的大![]() 键可用符号
键可用符号![]() 表示,其中m代表参与形成大
表示,其中m代表参与形成大![]() 键的原子数,n代表参与形成大
键的原子数,n代表参与形成大![]() 键的电子数(如苯分子中的大
键的电子数(如苯分子中的大![]() 键可表示为
键可表示为![]() ),则NO2的大
),则NO2的大![]() 键可表示为__。
键可表示为__。
(5)立方CrO2晶体的结构如图所示,晶胞参数为apm。
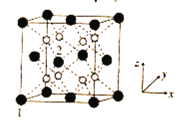
①设NA为阿伏加德罗常数的值,则CrO2的密度为__(列出计算式)g·cm-3。
②1、2号原子的坐标依次为(0,0,0)、(![]() ,0,
,0,![]() ),则原子坐标为(
),则原子坐标为(![]() ,
,![]() ,
,![]() )和(
)和(![]() ,
,![]() ,
,![]() )间的距离为__pm。
)间的距离为__pm。
【答案】3d54s1 4s 铬的价电子数比钾的多,原子半径比钾的小,铬的金属键比钾的强 N、O N 直线 sp ![]()
![]()
![]() a
a
【解析】
根据原子的核电荷数和能级图书写价电子排布式并分析失电子情况;根据配合物的组成结构分析;根据价层电子对数目和价层电子对互斥理论分析原子的杂化类型和空间构型;根据晶胞结构利用均摊法分析晶体的化学式并进行相关计算。
(1)基态Cr原子的核电荷数为24,其电子排布式为1s22s22p63s23p63d54s1,则价电子排布式为3d54s1;Cr成为阳离子时首先失去4s轨道的电子;
(2)铬与钾均位于第四周期,铬的价电子数比钾的多,原子半径比钾的小,铬的金属键比钾的强,则铬的熔点和沸点均比钾的高;
(3)由甘氨酸铬的结构可知,N、O原子提供孤对电子,形成配位键,则配合物的配位原子是N、O;
(4)①KSCN的四种组成元素K、S、C、N中,K是金属元素,第一电离能最小,C、N、O三种元素为同周期的主族元素,第一电离能随核电荷数增大而呈增大趋势,但N原子的2p轨道为半充满结构,相对稳定,三种元素的第一电离能由小到大的顺序为C<O<N,O、S同主族,O的非金属性强,第一电离能大,即O>S,则K、S、C、N四种元素的第一电离最大的是N元素;KSCN中SCN-离子中C原子价层电子对个数是2+![]() =2,且不含孤电子对,根据价层电子对互斥理论判断其空间构型为直线形,其中C原子杂化方式为sp;
=2,且不含孤电子对,根据价层电子对互斥理论判断其空间构型为直线形,其中C原子杂化方式为sp;
②NO2的结构可表示为![]() 则NO2的大π键可表示为
则NO2的大π键可表示为![]() ;
;
(5)①立方CrO2晶体的晶胞中含有黑球原子数目为8×![]() +6×
+6×![]() =4,白球数为8,则黑球为Cr,共含有4个CrO2,晶胞的质量为
=4,白球数为8,则黑球为Cr,共含有4个CrO2,晶胞的质量为![]() g=
g=![]() g,晶胞的体积为(a×10-10cm)3,则CrO2的密度
g,晶胞的体积为(a×10-10cm)3,则CrO2的密度![]() =
=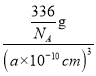 =
=![]() g·cm-3;
g·cm-3;
②在CrO2晶胞中1、2号原子的坐标依次为(0,0,0)、(![]() ,0,
,0,![]() ),说明晶胞的边长单位为1,则原子坐标为(
),说明晶胞的边长单位为1,则原子坐标为(![]() ,
,![]() ,
,![]() )和(
)和(![]() ,
,![]() ,
,![]() )分别为晶胞结构
)分别为晶胞结构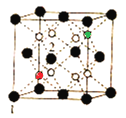 中的红色球和绿色球,两者之间的距离为晶胞体对角线的
中的红色球和绿色球,两者之间的距离为晶胞体对角线的![]() ,即为
,即为![]() pm=
pm=![]() a pm。
a pm。