题目内容
关于1s、2s、3s、4s原子轨道的说法,正确的是
| A.电子只能在电子云轮廓图中运动 |
| B.能级不同,电子云轮廓图形状相同 |
| C.轨道数目相同,电子云轮廓图形状、大小完全相同 |
| D.能层不同,电子云轮廓图形状也不相同 |
B
解析试题分析:A、电子在电子云轮廓图外出现的概率小,错误;B、都是s轨道,电子云轮廓图形状相同为球形,故B项正确,D项错误;C、大小不同,1s、2s、3s、4s逐渐变大,错误。
考点:本题考查电子云的形状及意义。

练习册系列答案
 名校联盟快乐课堂系列答案
名校联盟快乐课堂系列答案 黄冈创优卷系列答案
黄冈创优卷系列答案
相关题目
X、Y、Z、W四种短周期元素在周期表的位置如图,Y原子的最外层电子数是其次外层电子数的3倍,下列说法正确的是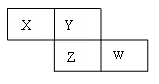
| A.气态氢化物的稳定性:X>Y |
| B.Z元素的氧化物对应的水化物一定是一种强酸 |
| C.X、Y、Z原子半径的大小顺序: X>Y>Z |
| D.X的气态氢化物与W的气态氢化物可以相互反应 |
已知镓(31Ga)和溴(35Br)是第四周期的主族元素。下列分析正确的是
| A.与镓同主族且相邻周期的元素,其原子序数为23或49 |
| B.与镓同周期且相邻主族的元素,其原子序数为30或32 |
| C.原子半径:Br>Ga> Cl> Al |
| D.碱性:KOH>Ga(OH)3>Al(OH)3 |
下列元素中非金属性最强的是
| A.氯 | B.氧 | C.氟 | D.溴 |
有X、Y、Z三种短周期元素,原子半径由大到小的顺序为Y>X>Z,原子序数之和为16。三种元素的常见单质在适当条件下可发生如图所示的变化,其中B和C均为10电子分子。有关判断不正确的是
| A.X元素位于ⅥA族 |
| B.A不能溶解于B中 |
| C.B的沸点高于C的沸点 |
| D.A和C不可能发生氧化还原反应 |
下列说法正确的是
| A.酸雨样品露天放置一段时间,酸性增强,是由于雨水所含成分被氧化的原因 |
| B.CH4、NH3、PH3的热稳定性逐渐增强 |
| C.因为酸性:HC1>HF,所以非金属性:Cl>F |
| D.钠原子在反应中失去的电子比铝原子少,故钠的金属性比铝弱 |
短周期主族元素X、Y、Z、W的原子序数依次增大,X原子核外最外层电子数是次外层的2倍,Y的氟化物YF3分子中各原子均达到8电子稳定结构,Z是同周期中原子半径最大的元素,W的最高正价为+7价。下列说法正确的是
| A.XH4的沸点比YH3高 |
| B.X与W形成的化合物和Z与W形成的化合物的化学键类型相同 |
| C.元素W的最高价氧化物对应水化物的酸性比Y的强 |
| D.X与Y形成的化合物的熔点可能比金刚石高 |
