题目内容
2.化学在生产和日常生活中有着重要的作用.下列有关说法正确的是( )| A. | “地沟油”经过加工处理后,可以用来制肥皂和生物柴油 | |
| B. | 氢氧化铁溶胶、水玻璃、淀粉溶液、PM2.5微粒均具有丁达尔效应 | |
| C. | 漂白粉在空气中久置变质 漂白粉中的CaCl2与空气中的CO2反应生成CaCO3 | |
| D. | 浓硫酸可刻蚀石英制艺术品 |
分析 A.地沟油属于油脂,油脂可发生皂化反应制肥皂;生物柴油是以动植物油脂、废餐饮用油等为原料与甲醇在催化剂作用下,进行酯交换制成的液体燃料;
B.丁达尔效应是胶体的特性;
C.氯化钙和二氧化碳不反应;
D、浓硫酸和二氧化硅不反应.
解答 解:A.地沟油经过皂化反应制肥皂,与甲醇在催化剂作用下进行酯交换制成生物柴油,故A正确;
B.水玻璃是硅酸钠的水溶液,无丁达尔效应,故B错误;
C.氯化钙是强酸盐,和二氧化碳不反应,CaCO3是次氯酸钙和二氧化碳反应生成的,故C错误;
D、浓硫酸和二氧化硅不反应,应用HF来雕刻,故D错误.
故选A.
点评 本题考查较为综合,涉及胶体、二氧化硅的性质等知识,为高频考点,有利于培养学生的良好的科学素养,提高学生的学习的积极性,难度不大.

练习册系列答案
 浙大优学小学年级衔接导与练浙江大学出版社系列答案
浙大优学小学年级衔接导与练浙江大学出版社系列答案 小学暑假作业东南大学出版社系列答案
小学暑假作业东南大学出版社系列答案 津桥教育暑假拔高衔接广东人民出版社系列答案
津桥教育暑假拔高衔接广东人民出版社系列答案 波波熊暑假作业江西人民出版社系列答案
波波熊暑假作业江西人民出版社系列答案
相关题目
12. 利用硫酸渣(主要含Fe2O3、SiO2、Al2O3、MgO等杂质)制备氧化铁的工艺流程如下:
利用硫酸渣(主要含Fe2O3、SiO2、Al2O3、MgO等杂质)制备氧化铁的工艺流程如下:

(1)“酸浸”中硫酸要适当过量,目的是:①抑制Fe3+的水解;②提高铁的浸出率.
(2)“还原”是将Fe3+转化为Fe2+,同时FeS2 被氧化为SO42-该反应的离子方程式为:14Fe3++FeS2+8H2O=15Fe2++2SO42-+16H+.
(3)为测定“酸浸”步骤后溶液中Fe3+的量,以控制加入FeS2 的量.实验步骤为:
准确量取一定体积的酸浸后的溶液于锥形瓶中,加入HCl、稍微过量的SnCl2 再加HgCl2 除去过量的SnCl2,以二苯胺磺酸钠为指示剂,用K2Cr2O7 标准液滴定,有关反应方程式如下:
2Fe3++Sn2++6Cl-=2Fe2++SnCl62-
Sn2++4Cl-+2HgCl2=SnCl62-+Hg2Cl2↓
6Fe2++Cr2O72-+14H+=6Fe3++2Cr3++7H2O
①加入稍微过量的SnCl2的目的是:确保Fe3+完全转化为Fe2+.
②若不加HgCl2,则测定的Fe3+ 量偏高(填“偏高”、“偏低”、“不变”).
(4)①滤液中含有少量Fe3+,试写出产生Fe3+的离子方程式表示:4Fe2++O2+4H+=4Fe3++2H2O
②已知部分阳离子一氢氧化物形式沉淀时,溶液的pH见下表:
实验可选用的试剂有:稀HNO3、Ba(NO3)2溶液酸性KMnO4溶液、NaOH溶液,要求制备过程中不产生有毒气体.请完成由“过滤”后的溶液模拟制备氧化铁的实验步骤:
a.向溶液中加入过量的酸性高锰酸钾溶液,搅拌;
b.滴加NaOH溶液,调节溶液为pH为3.2~3.8;
c.分离,洗涤; d.灼烧,研磨.
 利用硫酸渣(主要含Fe2O3、SiO2、Al2O3、MgO等杂质)制备氧化铁的工艺流程如下:
利用硫酸渣(主要含Fe2O3、SiO2、Al2O3、MgO等杂质)制备氧化铁的工艺流程如下:
(1)“酸浸”中硫酸要适当过量,目的是:①抑制Fe3+的水解;②提高铁的浸出率.
(2)“还原”是将Fe3+转化为Fe2+,同时FeS2 被氧化为SO42-该反应的离子方程式为:14Fe3++FeS2+8H2O=15Fe2++2SO42-+16H+.
(3)为测定“酸浸”步骤后溶液中Fe3+的量,以控制加入FeS2 的量.实验步骤为:
准确量取一定体积的酸浸后的溶液于锥形瓶中,加入HCl、稍微过量的SnCl2 再加HgCl2 除去过量的SnCl2,以二苯胺磺酸钠为指示剂,用K2Cr2O7 标准液滴定,有关反应方程式如下:
2Fe3++Sn2++6Cl-=2Fe2++SnCl62-
Sn2++4Cl-+2HgCl2=SnCl62-+Hg2Cl2↓
6Fe2++Cr2O72-+14H+=6Fe3++2Cr3++7H2O
①加入稍微过量的SnCl2的目的是:确保Fe3+完全转化为Fe2+.
②若不加HgCl2,则测定的Fe3+ 量偏高(填“偏高”、“偏低”、“不变”).
(4)①滤液中含有少量Fe3+,试写出产生Fe3+的离子方程式表示:4Fe2++O2+4H+=4Fe3++2H2O
②已知部分阳离子一氢氧化物形式沉淀时,溶液的pH见下表:
| 沉淀物 | Fe(OH)3 | Al(OH)3 | Fe(OH)2 | Mg(OH)2 | Mn(OH)2 |
| 开始沉淀 | 2.7 | 3.8 | 7.5 | 9.4 | 8.3 |
| 完全沉淀 | 3.2 | 5.2 | 9.7 | 12.4 | 9.8 |
a.向溶液中加入过量的酸性高锰酸钾溶液,搅拌;
b.滴加NaOH溶液,调节溶液为pH为3.2~3.8;
c.分离,洗涤; d.灼烧,研磨.
13.已知NaHSO3溶液显酸性,则NaHSO3溶液中微粒浓度关系不正确的是( )
| A. | c(H2SO3)+c(H+)=c(SO32-)+c(OH-) | B. | c(Na+)=2c(SO32-)+c(HSO3-) | ||
| C. | c(Na+)>c(HSO3-)>c(H+)>c(SO32-)>c(OH-) | D. | c(Na+)+c(H+)=2c(SO32-)+c(HSO3-)+c(OH-) |
17.金属的腐蚀除化学腐蚀和普通的电化学腐蚀外,还有“氧浓差腐蚀”,如在管道或缝隙等处的不同部位氧的浓度不同,在氧浓度低的部位是原电池的负极.下列说法正确的是( )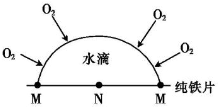

| A. | 纯铁的腐蚀属于电化学腐蚀 | |
| B. | 钢铁吸氧腐蚀时,负极的电极反应式为Fe-3e-═Fe3﹢ | |
| C. | 海轮在浸水部位镶一些铜锭可起到抗腐蚀作用 | |
| D. | 在图示氧浓差腐蚀中,M极处发生的电极反应为O2+2H2O+4e-═4OH- |
7.化学与科技、社会、生产、生活密切相关.下列有关说法不正确的是( )
| A. | 以地沟油为原料加工制成的生物柴油的成分与从石油分馏得到的柴油成分不同 | |
| B. | 在食品袋中放入盛有硅胶和铁粉的透气小袋,可防止食物受潮、氧化变质 | |
| C. | 绿色化学的核心是应用化学原理对环境污染进行治理 | |
| D. | 天然气、沼气和水煤气分别属于化石能源、可再生能源和二次能源 |
11.如图装置所示,铜片上发生的反应为( )


| A. | Zn2++2e-═Zn | B. | Cu2++2e-═Cu | C. | Zn-2e-═Zn2+ | D. | 2H++2e-═H2↑ |

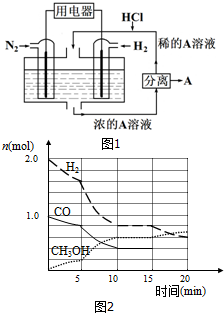 化学平衡原理是中学化学学习的重要内容.请回答下列问题:
化学平衡原理是中学化学学习的重要内容.请回答下列问题: