题目内容
10.如图所示,甲、乙是电化学实验装置,请回答下列问题:
若甲、乙两个烧杯中均盛放饱和NaCl溶液.
①甲中石墨棒上的电极反应式是O2+4e-+2H2O═4OH-
②乙中总反应的离子方程式为2Cl-+2H2O$\frac{\underline{\;通电\;}}{\;}$Cl2↑+2 OH-+H2↑
③若乙中含有0.10mol•L-1NaCl溶液400mL,当阳极产生的气体为560mL(标准状况下)时,溶液的pH=13(假设溶液体积变化忽略不计),转移电子的个数为3.612×1022 或0.06NA.
分析 ①甲为原电池装置,铁作负极,则石墨作正极,正极上氧气得电子;
②乙为电解装置,由电子流向可知石墨为阳极,阳极上氯离子放电,阴极上氢离子放电;
③根据电解方程式结合阳极上产物的体积计算电子转移数目,根据氢气和氢氧根离子之间的关系式计算溶液中氢氧根离子浓度计算pH.
解答 解:①甲为原电池装置,石墨棒上氧气得电子发生还原反应,反应为2H2O+O2+4e-═4OH-,
故答案为:2H2O+O2+4e-═4OH-;
②乙为电解装置,由电子流向可知石墨为阳极,阳极上氯离子放电,阴极上氢离子放电,则电解反应为2Cl-+2H2O $\frac{\underline{\;通电\;}}{\;}$H2↑+Cl2↑+2OH-,
故答案为:2Cl-+2H2O$\frac{\underline{\;通电\;}}{\;}$ H2↑+Cl2↑+2OH-;
③电解氯化钠溶液,在阳极上发生反应:2Cl--2e-=Cl2↑,0.10mol•L-1NaCl溶液400mL中含有氯离子是0.04mol,转移电子0.04mol,产生的氯气最多是0.02mol,产生氢氧根离子是0.04mol,阳极产生的气体为560mL即0.025mol(标准状况下)时,还会产生氧气0.005mol,4OH--4e-=O2+2H2O,转移电子0.02mol,所以氢氧根离子浓度$\frac{0.04}{0.4}$mol/L=0.1mol/L,所以pH=13,转移电子是0.06mol,个数是3.612×1022 或0.06NA,
故答案为:13;3.612×1022 或0.06NA.
点评 本题考查原电池与电解池的工作原理,明确离子放电顺序、电极反应式的书写即可解答,难度不大.

练习册系列答案
相关题目
20.下列实验目的可以实现或操作正确的是( )
| A. | 用托盘天平称取3.23 g NaCl固体 | |
| B. | 用10 mL 量筒量取 7.50 mL 稀盐酸 | |
| C. | 分液以后 下层液体从分液漏斗下端管口放出,关闭活塞,换一个接收容器,上层液体继续从分液漏斗下端管口放出 | |
| D. | 粗盐提纯中除泥沙的操作顺序是:溶解、过滤、蒸发 |
18.下列说法或表示方法正确的是( )
| A. | 由C(石墨)=C(金刚石)△H=+11.9 kJ/mol,可知金刚石比石墨稳定 | |
| B. | 等质量的硫蒸气和硫固体分别在氧气中完全燃烧,后者放出的热量多 | |
| C. | 水力(水能)按不同的分类可看成可再生能源和一级能源 | |
| D. | 可表示氢气燃烧热的热化学方程式为H2(g)+$\frac{1}{2}$O2(g)=H2O(g)△H=-241.8 kJ/mol |
15.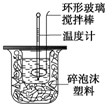 利用如图装置测定中和热的实验步骤如下:
利用如图装置测定中和热的实验步骤如下:
①用量筒量取50mL 0.25mol/L硫酸倒入小烧杯中,测出硫酸温度;
②用另一量筒量取50mL 0.55mol/L NaOH溶液,并用另一温度计测出其温度;
③将NaOH溶液倒入小烧杯中,设法使之混合均匀,测出混合液最高温度.
回答下列问题:
(1)写出稀硫酸和稀氢氧化钠溶液反应表示中和热的热化学方程式(中和热数值为57.3kJ/mol):$\frac{1}{2}$H2SO4(aq)+NaOH(aq)═$\frac{1}{2}$Na2SO4(aq)+H2O(l)△H=-57.3kJ•mol-1.
(2)倒入NaOH溶液的正确操作是C(从下列选出).
A.沿玻璃棒缓慢倒入 B.分三次少量倒入 C.一次迅速倒入
(3)使硫酸与NaOH溶液混合均匀的正确操作是D (从下列选出).
A.用温度计小心搅拌 B.揭开硬纸片用玻璃棒搅拌
C.轻轻地振荡烧杯 D.用套在温度计上的环形玻璃棒轻轻地搅动
(4)实验数据如下表:
①请填写下表中的空白:
②近似认为0.55mol/L NaOH溶液和0.25mol/L硫酸溶液的密度都是1g/cm3,中和后生成溶液的比热容c=4.18J/(g•℃).则中和热△H=-56.8kJ•mol-1
( 取小数点后一位).
③上述实验数值结果与57.3kJ/mol有偏差,产生偏差的原因可能是(填字母)abcd.
a.实验装置保温、隔热效果差
b.量取NaOH溶液的体积时仰视读数
c.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
d.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度
(5)已知:P4(白磷,s)+5O2(g)═P4O10(s)△H=-2983.2kJ/mol
P(红磷,s)+$\frac{5}{4}$O2(g)═$\frac{1}{4}$P4O10(s)△H=-738.5kJ/mol
试写出白磷转化为红磷的热化学方程式P4(白磷,s)=4P(红磷,s)△H=-29.2kJ/mol.
 利用如图装置测定中和热的实验步骤如下:
利用如图装置测定中和热的实验步骤如下:①用量筒量取50mL 0.25mol/L硫酸倒入小烧杯中,测出硫酸温度;
②用另一量筒量取50mL 0.55mol/L NaOH溶液,并用另一温度计测出其温度;
③将NaOH溶液倒入小烧杯中,设法使之混合均匀,测出混合液最高温度.
回答下列问题:
(1)写出稀硫酸和稀氢氧化钠溶液反应表示中和热的热化学方程式(中和热数值为57.3kJ/mol):$\frac{1}{2}$H2SO4(aq)+NaOH(aq)═$\frac{1}{2}$Na2SO4(aq)+H2O(l)△H=-57.3kJ•mol-1.
(2)倒入NaOH溶液的正确操作是C(从下列选出).
A.沿玻璃棒缓慢倒入 B.分三次少量倒入 C.一次迅速倒入
(3)使硫酸与NaOH溶液混合均匀的正确操作是D (从下列选出).
A.用温度计小心搅拌 B.揭开硬纸片用玻璃棒搅拌
C.轻轻地振荡烧杯 D.用套在温度计上的环形玻璃棒轻轻地搅动
(4)实验数据如下表:
①请填写下表中的空白:
| 温度 实验次数 | 起始温 度t1℃ | 终止温度t2/℃ | 温度差平均值(t2-t1)/℃ | ||
| H2SO4 | NaOH | 平均值 | |||
| 1 | 26.2 | 26.0 | 26.1 | 29.5 | |
| 2 | 27.0 | 27.4 | 27.2 | 32.3 | |
| 3 | 25.9 | 25.9 | 25.9 | 29.2 | |
| 4 | 26.4 | 26.2 | 26.3 | 29.8 | |
( 取小数点后一位).
③上述实验数值结果与57.3kJ/mol有偏差,产生偏差的原因可能是(填字母)abcd.
a.实验装置保温、隔热效果差
b.量取NaOH溶液的体积时仰视读数
c.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
d.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度
(5)已知:P4(白磷,s)+5O2(g)═P4O10(s)△H=-2983.2kJ/mol
P(红磷,s)+$\frac{5}{4}$O2(g)═$\frac{1}{4}$P4O10(s)△H=-738.5kJ/mol
试写出白磷转化为红磷的热化学方程式P4(白磷,s)=4P(红磷,s)△H=-29.2kJ/mol.
2.化学在生产和日常生活中有着重要的作用.下列有关说法正确的是( )
| A. | “地沟油”经过加工处理后,可以用来制肥皂和生物柴油 | |
| B. | 氢氧化铁溶胶、水玻璃、淀粉溶液、PM2.5微粒均具有丁达尔效应 | |
| C. | 漂白粉在空气中久置变质 漂白粉中的CaCl2与空气中的CO2反应生成CaCO3 | |
| D. | 浓硫酸可刻蚀石英制艺术品 |
19.下列离子方程式改写成化学方程式正确的是( )
| A. | Cu2++2OH-=Cu(OH)2↓ CuCO3+2NaOH═Cu(OH)2↓+Na2CO3 | |
| B. | CO32-+2H+=CO2↑+H2O BaCO3+2HCl═BaCl2+CO2↑+H2O | |
| C. | Ca2++CO32-=CaCO3↓ Ca(NO3)2+Na2CO3═CaCO3↓+2NaNO3 | |
| D. | H++OH-=H2O 2KOH+H2SO4═K2SO4+2H2O |
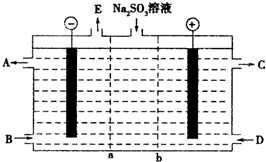 某研究小组用NaOH溶液吸收尾气中的二氧化硫,将所得的Na2SO3溶液进行电解循环再生,这种新工艺叫再生循环脱硫法.其中阴阳膜组合循环再生机理如图所示,
某研究小组用NaOH溶液吸收尾气中的二氧化硫,将所得的Na2SO3溶液进行电解循环再生,这种新工艺叫再生循环脱硫法.其中阴阳膜组合循环再生机理如图所示,