题目内容
【题目】铝土矿的主要成分是Al2O33H2O,还含有SiO2、Fe2O3等杂质。工业上从铝土矿中提取Al可采用如图所示工艺流程。(部分操作名称及反应条件已略去)

(1)B是___,X是___,若将盐酸与X互换,则B是___。
(2)生成C的离子方程式是___。
(3)D中的溶质是___,通入CO2后生成F的化学方程式是___,F的一种用途是___。
(4)由M生成铝的化学方程式是___,当有5.4g铝生成时,转移电子___mol。
(5)上述流程中的CO2能否用盐酸代替?理由是___。
【答案】SiO2 NaOH Fe2O3 Fe3++3OH-=Fe(OH)3↓ NaCl、NaOH、NaAlO2 NaAlO2+CO2+2H2O=Al(OH)3↓+NaHCO3 中和胃酸过多 2Al2O3(熔融)![]() 4Al+3O2↑ 0.6 不能,若用盐酸代替,则过量盐酸会溶解Al(OH)3,无法得到沉淀
4Al+3O2↑ 0.6 不能,若用盐酸代替,则过量盐酸会溶解Al(OH)3,无法得到沉淀
【解析】
铝土矿的主要成分是Al2O33H2O,还含有SiO2、Fe2O3等杂质,加入过量盐酸后,Al2O33H2O,转化为AlCl3和水,Fe2O3转化为FeCl3和水,SiO2不溶解,所以溶液A的成分为AlCl3、 FeCl3和过量盐酸,沉淀B为SiO2;加入过量NaOH(X)后,Fe3+生成Fe(OH)3而成为沉淀C的主要成分,此时溶液D的成分为NaAlO2、NaCl和NaOH;通入过量CO2后,所以沉淀F为Al(OH)3,溶液E为NaHCO3;F加热分解生成M为Al2O3,熔融电解生成铝和氧气。
(1)由以上分析知,B是SiO2,X是NaOH,若将盐酸与X互换,则先加NaOH溶液,不溶解的物质是氧化铁,所以B是Fe2O3。答案为:SiO2;NaOH;Fe2O3;
(2)C为Fe(OH)3,则由FeCl3与NaOH反应生成Fe(OH)3的离子方程式是Fe3++3OH-=Fe(OH)3↓。答案为:Fe3++3OH-=Fe(OH)3↓;
(3)由前面分析可知,D中的溶质是NaCl、NaOH、NaAlO2,通入CO2后与NaAlO2反应生成NaAlO2和NaHCO3,化学方程式是NaAlO2+CO2+2H2O=Al(OH)3↓+NaHCO3,Al(OH)3的一种用途是做胃药,用于中和胃酸过多。答案为:NaCl、NaOH、NaAlO2;NaAlO2+CO2+2H2O=Al(OH)3↓+NaHCO3;中和胃酸过多;
(4)由Al2O3熔融电解可生成铝和氧气,化学方程式是2Al2O3(熔融)![]() 4Al+3O2↑,当有5.4g铝(物质的量为
4Al+3O2↑,当有5.4g铝(物质的量为![]() =0.2mol)生成时,转移电子0.2mol ×3=0.6mol。答案为:2Al2O3(熔融)
=0.2mol)生成时,转移电子0.2mol ×3=0.6mol。答案为:2Al2O3(熔融)![]() 4Al+3O2↑;0.6;
4Al+3O2↑;0.6;
(5)上述流程中的若用CO2代替盐酸,则过量的盐酸会溶解Al(OH)3,最终得不到Al(OH)3沉淀,所以理由是:不能,若用盐酸代替,则过量盐酸会溶解Al(OH)3,无法得到沉淀。答案为:不能,若用盐酸代替,则过量盐酸会溶解Al(OH)3,无法得到沉淀。

 举一反三同步巧讲精练系列答案
举一反三同步巧讲精练系列答案 口算与应用题卡系列答案
口算与应用题卡系列答案 名师点睛字词句段篇系列答案
名师点睛字词句段篇系列答案【题目】I.(1)用H2O2和H2SO4的混合溶液可溶出印刷电路板金属粉末中的铜。写出反应的离子方程式:_______________________。
(2)控制其他条件相同,印刷电路板的金属粉末用10%H2O2和3.0 mol/L的H2SO4混合溶液处理,测得不同温度下铜的平均溶解速率(见下表)。
温 度(T) | 20 | 30 | 40 | 50 | 60 | 70 | 80 |
铜平均溶解速率×10-3mol·L-1·min-1 | 7.34 | 8.01 | 9.25 | 7.98 | 7.24 | 6.73 | 5.76 |
当温度高于40℃时,铜的平均溶解速率随着反应温度升高而下降,其主要原因是________________________________________________。
(3)在提纯后的CuSO4溶液中加入一定量的Na2SO3和NaCl溶液,加热,生成CuCl沉淀,制备CuCl的离子方程式是_________________________________________。
II.生活污水中的磷和氮主要以磷酸盐和铵盐形式存在。
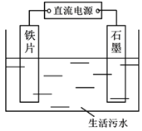
(1)除磷的原理如上图所示,利用电解法将PO43-转化为Fe3(PO4)2沉淀除去。铁作___________,(填“阴极”“阳极”),用化学用语表示产生Fe2+的主要过程:__________________________。
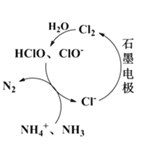
(2)有Cl-存在时,除氮原理如图所示,主要依靠电解产生的有效氯(HClO、ClO-)将NH4+或NH3氧化为N2.当pH<7时,主要发生HClO氧化NH4+的反应,其离子方程式为:_________________________________。