题目内容
某一化学反应在不同条件下的能量变化曲线如右图所示。下列说法正确的是
| A.化学催化比酶催化的效果好 |
| B.使用不同催化剂可以改变反应的热效应 |
| C.使用不同催化剂可以改变反应的能耗 |
| D.反应物的总能量低于生成物的总能量 |
C
解析

练习册系列答案
 中考解读考点精练系列答案
中考解读考点精练系列答案
相关题目
下列说法中错误的是
| A.化学反应中的能量变化通常表现为热量的变化 |
| B.化学键的断裂和形成是化学反应中能量变化的主要原因 |
| C.反应物总能量和生成物总能量的相对大小决定了反应是放出能量还是吸收能量 |
| D.需要加热才能发生的化学反应一定是吸热反应 |
已知25℃、101kPa条件下:
4Al (s) + 3O2 (g)=2Al2O3 (s) △H=-2834.9 kJ/mol
4Al (s) + 2O3 (g) = 2Al2O3 (s) △H= -3119.91kJ/mol
由此得出的结论正确的是
| A.等质量的O2比O3能量低,由O2变O3为放热反应 |
| B.等质量的O2比O3能量低,由O2变O3 为吸热反应 |
| C.3O2(g)=2O3 (g)△H=285.0 kJ/mol |
| D.O3比O2稳定,由O2变O3 为吸热反应 |
某反应的反应过程中能量变化如图所示(图中E1表示正反应的活化能,E2表示逆反应的活化能)。下列有关叙述正确的是( ) 
| A.该反应为放热反应 |
| B.该反应焓变可表示为△H=-(E1-E2)kJ·mol-1 |
| C.催化剂能降低反应的活化能 |
| D.催化剂能改变反应的焓变 |
用Cl2生产某些含氯有机物时会产生副产物HCl。 利用反应A:4HCl+O2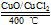 2Cl2+2H2O,
2Cl2+2H2O,
可实现氯的循环利用。
已知:Ⅰ.反应A中,4mol HCl被氧化,放出115.6kJ的热量.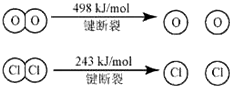
Ⅱ.则断开1 mol H—O键与断开1 mol H—Cl键所需能量相差约为
| A.16kJ | B.24kJ | C.32kJ | D.48kJ |
下列有关中和热的说法正确的是( )
| A.表示中和热的热化学方程式:H+(l)+OH-(l)=H2O(l) ΔH=-57.3 kJ/mol |
| B.准确测量中和热的实验过程中,至少需测定温度4次 |
| C.中和热的实验过程中,环形玻璃搅拌棒材料若用铜代替,则测量出的中和热数值偏小 |
| D.已知2NaOH(aq)+H2SO4(aq)=Na2SO4(aq)+2H2O(l) ΔH=-114.6 kJ/mol,则该反应的中和热为114.6 kJ/mol |
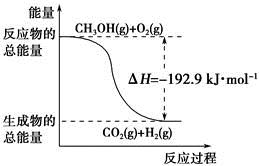
已知:①CH3OH(g)+H2O(g)=CO2(g)+3H2(g) ΔH=+49.0 kJ·mol-1
②CH3OH(g)+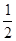 O2(g)=CO2(g)+2H2(g) ΔH=-192.9 kJ·mol-1
O2(g)=CO2(g)+2H2(g) ΔH=-192.9 kJ·mol-1
下列说法正确的是
| A.CH3OH转变成H2的过程一定要吸收能量 |
| B.①反应中,反应物的总能量高于生成物总能量 |
C.根据②推知反应:CH3OH(l)+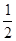 O2(g)=CO2(g)+2H2(g)的ΔH>-192.9 kJ·mol-1 O2(g)=CO2(g)+2H2(g)的ΔH>-192.9 kJ·mol-1 |
| D.反应②中的能量变化如下图所示 |
氯原子对O3分解有催化作用:O3+Cl=ClO+O2 ΔH1,ClO+O=Cl+O2 ΔH2,大气臭氧层的分解反应是:O3+O=2O2 ΔH,该反应的能量变化示意图如图所示,下列叙述中,正确的是( )
| A.反应O3+O=2O2的ΔH=E1-E3 |
| B.反应O3+O=2O2的ΔH=E2-E3 |
| C.O3+O=2O2是吸热反应 |
| D.ΔH=ΔH1+ΔH2 |