题目内容
【题目】实验室用含有杂质(FeO、Fe2O3)的废CuO制备胆矾晶体,经历了下列过程(已知 Fe3+在 pH=5时沉淀完全).其中分析错误的是
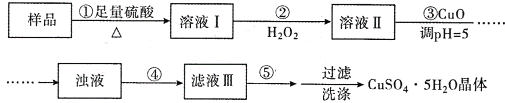
A. 步骤②发生的主要反应为:2Fe2++H2O2+2H+=2Fe3++2H2O
B. 步骤②不能用氯水、硝酸等强氧化剂代替H2O2
C. 步骤③用 CuCO3代替CuO也可调节溶液的pH
D. 步骤④为过滤,步骤⑤蒸发结晶
【答案】D
【解析】
样品中含有FeO、Fe2O3和CuO,加入足量硫酸后,固体溶解转化为Cu2+,Fe2+,Fe3+,加入过氧化氢溶液后,亚铁离子氧化为Fe3+,调节pH=5,铁离子沉淀为氢氧化铁,过滤,蒸发浓缩,冷却结晶后得到胆矾晶体。
A. 步骤②中亚铁离子与过氧化氢在酸性环境下发生反应2Fe2++H2O2+2H+=2Fe3++2H2O,A正确;
B. 步骤②若用氯水、硝酸等强氧化剂代替H2O2,会引入氯原子、硝酸根新的杂质,不利于胆矾的回收,同时造成环境污染,B正确;
C. 步骤③用 CuCO3代替CuO也可调节pH,碳酸铜与硫酸反应产生硫酸铜,二氧化碳和水,不会引入新的杂质,C正确;
D. 步骤④为过滤,步骤⑤为蒸发浓缩,冷却结晶,D错误;
答案为D。

练习册系列答案
相关题目