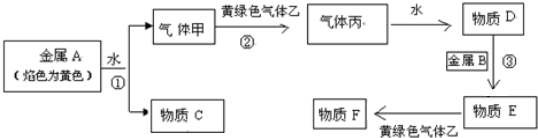
题目内容
4.化学与生活(1)随着社会的发展,体育场馆和城市交通建设日臻完善.
①体育场馆建设需大量玻璃.生产玻璃的主要原料是石灰石、纯碱和c(填字母).
a.黏土 b.石膏 c.石英
②轨道交通建设需大量金属材料.下列金属材料最易发生腐蚀的是b(填字母).
a.铝合金 b.钢铁 c.纯铜
③“塑胶”跑道是由聚氨酯橡胶等材料建成.聚氨酯橡胶属于c(填字母).
a.金属材料 b.无机非金属材料 c.有机高分子材料
(2)保持营养平衡、科学使用食品添加剂,有助于人体健康.
①维生素是人体必需的营养素,人患有干眼症、夜盲症是缺乏维生素A.
在一支盛有2mL2%淀粉溶液的试管中滴入2滴碘水.溶液呈蓝色,再滴入维生素C的水溶液,溶液颜色退去,该实验说明维生素C还原性(选填:“酸”、“氧化”或“还原”).
②图为某品牌鸡精标签的一部分,其中淀粉在人体内的最终水解产物是葡萄糖,属于着色剂的是姜黄,属于防腐剂的是山梨酸.

(3)“绿水蓝天”是我们向往的优良环境.
①某工厂产生大量含盐酸的酸性废水,可以加入b处理(填字母)
a.硝酸银 b.生石灰 c.活性炭
处理后的水中还含有的悬浮颗粒物等杂质,可以加入硫酸铁等混凝剂进行净化处理,硫酸铁的净水原理是Fe3++H2O?Fe(OH)3(胶体)+3H+(用离子方程式表示).
②SO2是重要的空气污染物,控制和治理SO2能减少硫酸型酸雨的形成.请你写出有利于降低大气中SO2浓度的一项措施煤固硫、回收废气中二氧化硫等.
③大量PM2.5会造成灰霾天气,危害人体健康.燃煤气化有助于控制PM2.5的含量,写出焦炭与水蒸气反应的化学方程式C+H2O$\frac{\underline{\;高温\;}}{\;}$CO+H2.
分析 (1)①生产玻璃的主要原料是石灰石、纯碱和石英;
②原电池能加快化学反的速率;
③材料分为金属材料、无机非金属材料、合成材料和复合材料、有机合成高分子材料,利用题干提供的信息结合相关的化学知识即可解题;
(2)①维生素是人体必需的营养素,人患有干眼症、夜盲症是缺乏维生素A;当滴入维生素C的水溶液,溶液颜色退去,说明碘与维生素C反应,碘是氧化剂,维生素是还原剂;
②根据淀粉在人体内的最终水解产物是葡萄糖判断;柠檬黄、胭脂红、胡萝卜素等是常用的着色剂;根据苯甲酸钠、山梨酸钾是常用的防腐剂判断;
(3)①酸性废水加碱用中和法处理;硫酸铁的净水原理是Fe3++H2O?Fe(OH)3(胶体)+3H+,形成胶体吸附;
②SO2是重要的空气污染物,控制和治理SO2能减少硫酸型酸雨的形成.可以采用煤固硫、回收废气中二氧化硫等降低大气中SO2浓度;
③焦炭与水蒸气反应生成CO和H2.
解答 解:(1)①生产玻璃的主要原料是石灰石、纯碱和石英,故答案为:c;
②铝的活动性非常强,常温下即可与氧气反应,在表面形成致密的氧化铝薄膜,阻止进一步氧化,所以铝在空气中具有较强的抗腐蚀性;钢铁一形成原电池,加快腐蚀;铜不活泼不易被腐蚀,故答案为:b;
③有机合成高分子材料,分天然产生的高分子化合物和人工合成的高分子化合物,棉花、羊毛、天然橡胶是天然存在的,塑料、合成橡胶、合成纤维是人工合成的,聚氨酯橡胶是人工合成的橡胶,故答案为:c;
(2)①维生素是人体必需的营养素,人患有干眼症、夜盲症是缺乏维生素A;当滴入维生素C的水溶液,溶液颜色退去,说明碘与维生素C反应,碘是氧化剂,维生素是还原剂,故答案为:维生素A;还原性;
②淀粉在人体内的最终水解产物是葡萄糖,姜黄是着色剂;山梨酸是防腐剂;故答案为:葡萄糖;姜黄;山梨酸;
(3)①酸性废水加碱用中和法处理,所以选b;硫酸铁的净水原理是Fe3++H2O?Fe(OH)3(胶体)+3H+,形成胶体吸附,故答案为:b;Fe3++H2O?Fe(OH)3(胶体)+3H+;
②SO2是重要的空气污染物,控制和治理SO2能减少硫酸型酸雨的形成.可以采用煤固硫、回收废气中二氧化硫等降低大气中SO2浓度,故答案为:硫酸;煤固硫、回收废气中二氧化硫;
③焦炭与水蒸气反应生成CO和H2,方程式为:C+H2O $\frac{\underline{\;高温\;}}{\;}$CO+H2,故答案为:C+H2O $\frac{\underline{\;高温\;}}{\;}$CO+H2.
点评 本题主要考查了化学与生活中的知识,涉及内容较多,平时注意基础知识的积累,题目较简单.

 阅读快车系列答案
阅读快车系列答案(1)SiO2是玻璃的主要成分之一,保存氢氧化钠溶液的玻璃瓶应用橡胶塞的原因是SiO2+2NaOH═Na2SiO3+H2O(用化学方程式表示);Na2SiO3可通过SiO2与纯碱混合高温熔融反应制得,高温熔融纯碱时下列坩埚可选用的是D.
A.普通玻璃坩埚 B.石英玻璃坩埚 C.氧化铝坩埚 D.铁坩埚
(2)高纯硅是现代信息、半导体和光伏发电等产业都需要的基础材料.工业上提纯硅有多种路线,其中一种工艺流程示意图及主要反应如下:
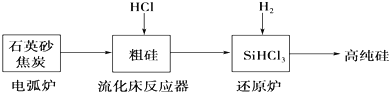
①用石英砂和焦炭在电弧炉中制粗硅,该反应的化学方程式为SiO2+3C$\frac{\underline{\;高温\;}}{\;}$SiC+2CO↑.
②在流化床反应的产物中,SiHCl3大约占85%,还有SiCl4、SiH2Cl2、SiH3Cl等,有关物质的沸点数据如下表,提纯SiHCl3的主要工艺操作依次是沉降、冷凝和精馏(或蒸馏).
| 物质 | Si | SiCl4 | SiHCl3 | SiH2Cl2 | SiH3Cl | HCl | SiH4 |
| 沸点/℃ | 2 355 | 57.6 | 31.8 | 8.2 | -30.4 | -84.9 | -111.9 |
(1)“氯盐类”融雪剂主要成分的晶体类型为离子晶体;
(2)冰比硫化氢热稳定性高的原因是O-H键的键长小于H-S键的键长.
(3)已知X、Y和Z为第三周期元素,其原子的第一至第四电离能如表所示:
| 电离能/kJ•mol-1 | I1 | I2 | I3 | I4 |
| X | 578 | 1817 | 2745 | 11578 |
| Y | 738 | 1451 | 7733 | 10540 |
| Z | 496 | 4562 | 6912 | 9543 |
(4)融雪剂对环境危害很大,如和路基上的铁等金属形成原电池,加快路面破损.铁元素应用广泛,Fe2+与KCN溶液反应得Fe(CN)2沉淀,KCN过量时沉淀溶解,生成配合物黄血盐.
①写出亚铁离子的核外电子排布式[Ar]3d6;
②已知CN-与 N2结构相似,1mol CN-中π键数目为2NA.
| A. | NaA 溶液呈碱性 | |
| B. | 升高温度,HA 溶液的pH 增大 | |
| C. | HA 电离平衡常数约为1×10-7 | |
| D. | 将该溶液稀释100 倍后,pH 介于4 至6 之间 |