题目内容
12.看是否符合题设条件及要求.如“过量”“少量”“物质的量”“适量”“任意量”以及滴加顺序等对反应方式的影响如:往FeBr2溶液中通入少量C12的离子方程式为2Fe2++C12═2Fe3++2Cl-,往FeBr2溶液中通入过量C12的离子方程式为:3Cl2+2Fe2++4Br-═2Fe3++6Cl-+2Br2.分析 二价铁离子、溴离子都具有还原性,二价铁离子还原性强于氯气,溴化亚铁中通入氯气,氯气先氧化二价铁离子,剩余氯气再氧化溴离子,若氯气足量,二价铁离子、溴离子都被氧化生成三价铁离子和溴单质,据此写出反应离子方程式.
解答 解:二价铁离子、溴离子都具有还原性,二价铁离子还原性强于氯气,溴化亚铁中通入氯气,氯气先氧化二价铁离子,剩余氯气再氧化溴离子,往FeBr2溶液中通入过量C12,二价铁离子、溴离子都被氧化,离子方程式:3Cl2+2Fe2++4Br-═2Fe3++6Cl-+2Br2,
故答案为:3Cl2+2Fe2++4Br-═2Fe3++6Cl-+2Br2.
点评 本题考查了离子方程式的书写,侧重考查反应物用量不同发生反应不同的离子反应,明确二价铁离子、溴离子还原性强弱,明确反应物用量是解题关键,题目难度中等.

练习册系列答案
相关题目
2.S原子的摩尔质量是32g/mol,1mol H2SO4的质量是98g,2mol H2SO4约有8NA个氧原子.0.49kg H2SO4中含有5mol H2SO4 2mol Ne含有20NA个电子.
3.在一定温度下的恒容密闭容器中,反应A(s)+2B(g)?C(g)+D(g),反应已达到平衡的标志是( )
| A. | 反应混合物中各组分的浓度相等 | B. | 混合气体的密度不再改变 | ||
| C. | 混合气体的压强不再变化 | D. | 两种物质C、D的反应速率之比为1:1 |
17.不能用H++OH-=H2O表示的反应是( )
| A. | 盐酸与氢氧化钾溶液反应 | B. | 稀盐酸与氢氧化钠溶液反应 | ||
| C. | 稀硝酸与氢氧化钠溶液反应 | D. | 硅酸与氢氧化钠溶液反应 |
4.下列图示与对应的叙述相符的是( )
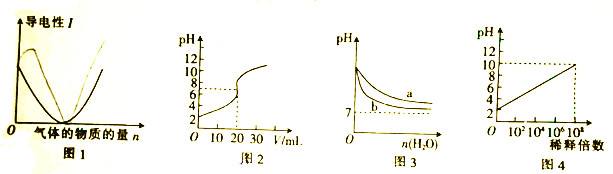

| A. | 图1可表示向醋酸溶液中通入氨气时,溶液导电性随氨气量的变化 | |
| B. | 图2所示实验为常温下用0.01mol•L-1的HCl溶液滴定20mL0.01mol•L-1的NaOH溶液 | |
| C. | 图2可表示常温下pH相同的NaOH溶液与氨水稀释过程的pH变化,其中曲线b是氨水的pH变化 | |
| D. | 图4可以表示常温下pH=2的HCl溶液加水稀释倍数与pH的变化关系 |
16.为提纯如表物质(括号内为杂质)选用的试剂和分离方法都正确的是( )
| 物质 | 试剂 | 分离方法 | |
| ① | KNO3(NaCl) | 蒸馏水 | 降温结晶 |
| ② | CO2(HCl) | 饱和Na2CO3溶液 | 洗气 |
| ③ | 乙酸乙酯(乙酸) | NaOH溶液 | 分液 |
| ④ | Cl2(HCl) | 饱和NaCl溶液 | 洗气 |
| A. | ①③ | B. | ①④ | C. | 只有 ④ | D. | ③④ |
17.下列描述正确的是( )
| A. | 氯水的标签上应标注: | B. | O2-的结构示意图: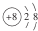 | ||
| C. | 乙烯的结构简式:CH2CH2 | D. | BeCl2的电子式: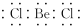 |