题目内容
20.取agNa2O2与bgNaHCO3固体混合物,置于密闭容器中,加热到250℃,充分反应后,最后排出的气体和剩余固体均由两种物质组成.问:(1)排出的气体和留下的固体成分各是什么?
(2)$\frac{a}{b}$的取值范围?
分析 混合物在密闭容器中加热到250℃时,可能发生如下反应:
①2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO2↑+H2O↑
②2Na2O2+2CO2=2Na2CO3+O2
③2Na2O2+2H2O=4NaOH+O2
④2NaOH+CO2=Na2CO3+H2O?
反应生成气体产物是O2和H2O(g),根据方程式,从质量守恒的角度计算.
解答 解:(1)混合物在密闭容器中加热到250℃时,可能发生如下反应:
①2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO2↑+H2O↑
②2Na2O2+2CO2=2Na2CO3+O2
③2Na2O2+2H2O=4NaOH+O2
④2NaOH+CO2=Na2CO3+H2O?
反应生成气体产物是O2和H2O(g),依题意可知,残余的固体为Na2CO3和NaOH,答:反应生成气体产物是O2和H2O(g),依题意可知,残余的固体为Na2CO3和NaOH;
(2)生成的气体为O2和H2O(g),则有总反应式为?
bNaHCO3+aNa2O2=bNa2CO3+(2a-b)NaOH+(b-a)H2O+$\frac{a}{2}$O2
所以 2a-b>0,$\frac{a}{b}$>$\frac{1}{2}$,b-a>0,$\frac{a}{b}$<1.故$\frac{a}{b}$的数值范围:$\frac{1}{2}$<$\frac{a}{b}$<1.
答:取值范围为:$\frac{1}{2}$<$\frac{a}{b}$<1.
点评 本题考查了有关混合物反应的计算,题目难度较大,解题根据是根据题中信息判断反应产物的组成,注意质量守恒在化学计算中的应用,试题培养了学生的分析、理解能力及灵活应用所学知识的能力.

| 容器 编号 | 起始时各物质的物质的量/mol | 达到平衡时体系能量的变化 | ||
| X2 | Y2 | XY3 | ||
| ① | 1 | 3 | 0 | 放热:23.15k J |
| ② | 0.8 | 2.4 | 0.4 | Q(Q>0) |
| A. | 容器①、②中反应的平衡常数相等 | |
| B. | 达到平衡时,两个容器中XY3的物质的量浓度均为2mol/L | |
| C. | 容器②中反应达到平衡时吸收的热量为QkJ | |
| D. | 若容器①的体积为0.2L,则达到平衡时放出的热量大于23.15kJ |
| A. | 充电过程是化学能转化为电能的过程 | |
| B. | 充电时阳极反应为Cd(OH)2+2e-═Cd+2OH - | |
| C. | 放电时电池内部OH-向正极移动 | |
| D. | 充电时与直流电源正极相连的电极上发生Ni(OH)2转化为NiO(OH)的反应 |
| 选项 | 物质 | 杂质 | 试剂 | 主要操作 |
| A | SiO2 | Fe2O3 | HCl | 过滤 |
| B | Na2CO3 | NaCl | BaCl2 | 过滤 |
| C | Fe Cl3 | Fe Cl2 | Fe | 过滤 |
| D | 碘水 | Br2 | CCl4 | 萃取 |
| A. | A | B. | B | C. | C | D. | D |
| A. | 一氧化碳通过灼热的氧化铁 | B. | 氧化铝溶于盐酸 | ||
| C. | 过氧化钠固体中通人水蒸气 | D. | 氢氧化亚铁露置在空气中 |
①SiO2+2C$\frac{\underline{\;高温\;}}{\;}$ Si+2CO
②Si+2Cl2$\frac{\underline{\;点燃\;}}{\;}$SiCl4
③SiCl4+2H2Si+4HCl,
其中,反应②属于( )
| A. | 化合反应 | B. | 分解反应 | C. | 置换反应 | D. | 复分解反应 |
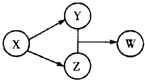 X、Y、Z、W四种物质的转化关系如图所示(部分反应物和产物已经省略).下列组合中不符合该关系的是
X、Y、Z、W四种物质的转化关系如图所示(部分反应物和产物已经省略).下列组合中不符合该关系的是 | A | B | C | D | |
| X | HCl | Na2O2 | Na2CO3 | Al2O3 |
| Y | FeCl2 | NaOH | CO2 | AlCl3 |
| Z | Cl2 | Na2CO3 | CaCO3 | NaAlO2 |
| W | FeCl3 | NaHCO3 | Ca(HCO3)2 | Al(OH)3 |
| A. | A | B. | B | C. | C | D. | D |