题目内容
| |||||||||||||||||||
答案:2.热交换器;
解析:
解析:
(1) |
K= |
(3) |
增大,常压下已经有较大的反应速率和转化率,可节约成本,催化剂活性最大(各1分,共3分) |
(4) |
降低温度(1分);22.2%(2分), 图(2分)(要求:变化趋势正确,且注意量的比例).
|

练习册系列答案
 53天天练系列答案
53天天练系列答案
相关题目
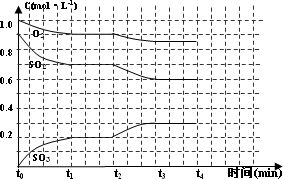
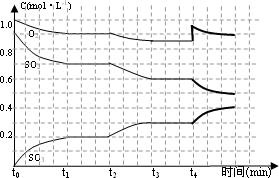
 2SO3(g) ;△H<0。在2L恒容的密闭容器中,加入3molSO3(g)和lmol氧气,在一定温度下使其反应,反应至4min时,氧气的浓度为0.6mol·L-1,当反应到8min时,反应到达平衡,此时c(SO3)=a mol·L-1。
2SO3(g) ;△H<0。在2L恒容的密闭容器中,加入3molSO3(g)和lmol氧气,在一定温度下使其反应,反应至4min时,氧气的浓度为0.6mol·L-1,当反应到8min时,反应到达平衡,此时c(SO3)=a mol·L-1。