题目内容
10.下列说法正确的是( )| A. | 金属元素均位于主族与副族 | |
| B. | 过渡元素均是金属元素 | |
| C. | 非金属元素均位于元素周期表的右上方 | |
| D. | 锕系元素有14种且均位于第ⅢB族 |
分析 A.Ⅷ族元素都为金属;
B.过渡元素又称为过渡金属元素;
C.H为非金属,位于左上方;
D.锕系元素有15种.
解答 解:A.Ⅷ族元素都为金属,可知金属元素不仅仅位于主族、副族,故A错误;
B.过渡元素又称为过渡金属元素,可知过渡元素均是金属元素,故B正确;
C.H为非金属,位于左上方,可知非金属不仅仅位于元素周期表的右上方,故C错误;
D.锕系元素有15种,故D错误.
故选B.
点评 本题考查元素周期律,为高频考点,题目难度不大,熟悉元素在周期表中的位置及元素的性质即可解答,注重元素位置与性质的考查..

练习册系列答案
相关题目
20.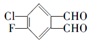 分子被称为“福禄双全宝宝”.苯环上连一个氟原子、一个氯原子、两个邻位醛基的其他“福禄双全宝宝”还有几种( )
分子被称为“福禄双全宝宝”.苯环上连一个氟原子、一个氯原子、两个邻位醛基的其他“福禄双全宝宝”还有几种( )
 分子被称为“福禄双全宝宝”.苯环上连一个氟原子、一个氯原子、两个邻位醛基的其他“福禄双全宝宝”还有几种( )
分子被称为“福禄双全宝宝”.苯环上连一个氟原子、一个氯原子、两个邻位醛基的其他“福禄双全宝宝”还有几种( )| A. | 3种 | B. | 4种 | C. | 5种 | D. | 6种 |
1.下列化学式只代表一种物质分子的是( )
| A. | CH2Cl2 | B. | C2H4Cl2 | C. | C4H10 | D. | C5H12 |
18.下列有关说法正确的是( )
| A. | CuS、FeS、SO3、FeCl2均可由单质直接化合生成 | |
| B. | 硫在空气中的燃烧产物是SO2,在纯氧中的燃烧产物是SO3 | |
| C. | SO2使酸性KMnO4溶液褪色的原因是因为SO2具有还原性 | |
| D. | SO2和O2按物质的量之比2:1通入密闭容器中充分反应后,容器中只有SO3 |
5.苯的结构是 ,下列说法正确的是( )
,下列说法正确的是( )
 ,下列说法正确的是( )
,下列说法正确的是( )| A. | 它有单键 | B. | 能发生取代反应 | ||
| C. | 它还有双键,所以可以起加成反应 | D. | 乙烯和苯都能和溴水反应褪色 |
15.下列有关物质用途的说法中,不正确的是( )
| A. | 硅可用作绝缘材料 | |
| B. | 氯气可用于制取漂白粉 | |
| C. | 二氧化硅可用于制造光导纤维 | |
| D. | 氢氧化铝可用于制造中和胃酸的药剂 |
2.烃 是由某烯烃A在一定条件下与氢气按1:1的体积比加成生成的,则由此可推断出烯烃A可能的结构有几种( )
是由某烯烃A在一定条件下与氢气按1:1的体积比加成生成的,则由此可推断出烯烃A可能的结构有几种( )
 是由某烯烃A在一定条件下与氢气按1:1的体积比加成生成的,则由此可推断出烯烃A可能的结构有几种( )
是由某烯烃A在一定条件下与氢气按1:1的体积比加成生成的,则由此可推断出烯烃A可能的结构有几种( )| A. | 9种 | B. | 7种 | C. | 5种 | D. | 4种 |
19.低碳经济是以低能耗、低污染、低排放为基础的经济模式.低碳经济的概念在中国正迅速从高端概念演变成全社会的行为,在新能源汽车、工业节能等多个领域都大有作为. 请运用化学反应原理的相关知识研究碳及其化合物的性质.
(1)工业上可利用CO或CO2来制备清洁液体燃料甲醇.已知:800℃时,化学反应①、反应②对应的平衡常数分别为2.5、1.0.
反应①:2H2(g)+CO(g)?CH3OH(g)△H=-90.8kJ•mol-1
反应②:H2(g)+CO2(g)?H2O (g)+CO(g)△H=+41.2kJ•mol-1
写出用CO2与H2反应制备甲醇的热化学方程式3H2(g)+CO2(g)?CH3OH(g)+H2O(g)△H=-49.6kJ/mol,800℃时该反应的化学平衡常数K的数值为2.5.
现将不同量的CO2 (g)和H2(g)分别通入到容积为2L恒容密闭容器中进行反应②,得到如表二组数据:
实验2中,若平衡吋,CO2 (g)的转化率小于H2(g),则a、b必须满足的关系是a>b.
若在900℃时,另做一组实验,在此容器中加入10mol CO2,5mol H2,2mol CO,5mol H2O (g)(g),则此时v正>v逆(填“>”、“>”或“=”).
(2)工业上可通过甲醇羰基化法制取甲酸甲酯,其反应的热化学方程式为:CH3OH(g)+CO(g)→HCOOCH3(g)△H=-29.1KJ•mol-1,科研人员对该反应进行了研究,部分研究结果如下:

①从反应压强对甲醇转化率的影响“效率”看,工业制取甲酸甲酯应选择的压强是4.0×106Pa(填“3.5×106Pa”“4.0×106 Pa”或“5.0×106Pa”).
②实际工业生产中采用的温度是80℃,其理由是高于80℃时,温度对反应速率影响较小,且反应放热,升高温度时平衡逆向移动,转化率降低.
(3)已知常温下NH3•H2O的电离平衡常数K=1.75×10-5,H2CO3的电离平衡常数K1=4.4×10-7,K2=4.7×10-11.常温下,用氮水吸收CO2可得到NH4HCO3溶液,NH4HCO3溶液呈碱性(填“酸性”“中性”或“碱性”),溶液中离子浓度由大到小的顺序为:c(NH4+)>c(HCO3-)>c(OH-)>c(H+)>c(CO32-).
(1)工业上可利用CO或CO2来制备清洁液体燃料甲醇.已知:800℃时,化学反应①、反应②对应的平衡常数分别为2.5、1.0.
反应①:2H2(g)+CO(g)?CH3OH(g)△H=-90.8kJ•mol-1
反应②:H2(g)+CO2(g)?H2O (g)+CO(g)△H=+41.2kJ•mol-1
写出用CO2与H2反应制备甲醇的热化学方程式3H2(g)+CO2(g)?CH3OH(g)+H2O(g)△H=-49.6kJ/mol,800℃时该反应的化学平衡常数K的数值为2.5.
现将不同量的CO2 (g)和H2(g)分别通入到容积为2L恒容密闭容器中进行反应②,得到如表二组数据:
| 实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
| CO2 (g) | H2(g) | H2(g) | CO2 (g) | |||
| 1 | 900 | 4 | 6 | 1.6 | 2.4 | 2 |
| 2 | 900 | a | b | c | d | t |
若在900℃时,另做一组实验,在此容器中加入10mol CO2,5mol H2,2mol CO,5mol H2O (g)(g),则此时v正>v逆(填“>”、“>”或“=”).
(2)工业上可通过甲醇羰基化法制取甲酸甲酯,其反应的热化学方程式为:CH3OH(g)+CO(g)→HCOOCH3(g)△H=-29.1KJ•mol-1,科研人员对该反应进行了研究,部分研究结果如下:

①从反应压强对甲醇转化率的影响“效率”看,工业制取甲酸甲酯应选择的压强是4.0×106Pa(填“3.5×106Pa”“4.0×106 Pa”或“5.0×106Pa”).
②实际工业生产中采用的温度是80℃,其理由是高于80℃时,温度对反应速率影响较小,且反应放热,升高温度时平衡逆向移动,转化率降低.
(3)已知常温下NH3•H2O的电离平衡常数K=1.75×10-5,H2CO3的电离平衡常数K1=4.4×10-7,K2=4.7×10-11.常温下,用氮水吸收CO2可得到NH4HCO3溶液,NH4HCO3溶液呈碱性(填“酸性”“中性”或“碱性”),溶液中离子浓度由大到小的顺序为:c(NH4+)>c(HCO3-)>c(OH-)>c(H+)>c(CO32-).
20.下列说法错误的是( )
| A. | 熔融态及溶于水后都不导电,熔沸点很低的物质一定属于分子晶体 | |
| B. | 甲醛和乙炔分子中均在σ键和π键,且每个分子中σ键数目相同 | |
| C. | 三氯化磷、二氧化碳、白磷分子中各原子均满足8电子的稳定结构 | |
| D. | HF、HCl、HBr、HI的热稳定性和酸性均依次减弱 |