题目内容
pH=4的NH4Cl溶液和pH=10的Na2CO3溶液中,水的电离度分别为 ,则它们的大小关系是
,则它们的大小关系是
 ,则它们的大小关系是
,则它们的大小关系是A.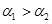 | B. | C. | D.无法判断 |
C
试题分析:pH=4的NH4Cl是强酸弱碱盐,水电离的OH-大部分被NH4+消耗生成NH3.H2O,只有
少量水电离的OH-剩余,形成溶液的OH-, 而水电离的H+积累形成溶液的H+,即
[H+]水=[H+]溶液=10-4;而pH=10的Na2CO3是强碱弱酸盐,水电离的H+大部分被CO32-消耗生成HCO3-、H2CO3,只有少量水电离的H+剩余,形成溶液的H+,而水电离的OH-积累形成溶液的OH-,即[OH-]水=[OH-]溶液,又因为[H+]溶液=10-10,所以,[OH-]溶液=10-4,即[OH-]水=10-4。又因为[H+]水=[OH-]水,所以,两者水的解离度相等。
点评:本题考查盐对水电离的影响,在对水电离因素的影响中,要重点掌握酸碱抑制水的电
离,盐要具体问题具体分析。

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
 )分别为?a、b、c(单位为mol/L),则下列判断正确的是
)分别为?a、b、c(单位为mol/L),则下列判断正确的是 HCO3-+ OH-热的纯碱溶液清洗油污
HCO3-+ OH-热的纯碱溶液清洗油污