题目内容
【题目】含碘食盐中的碘是以碘酸钾(KIO3)形式存在的。已知在酸性溶液中IO3-和I-发生下列反应IO3-+5I-+6H+=3I2+3H2O。现有下列物质 ①稀硫酸;②pH试纸;③淀粉碘化钾溶液;④淀粉溶液。利用上述反应,可用来检验含碘食盐中含有IO3-的是
A.①③B.②③C.①④D.②④
【答案】A
【解析】
由IO3-+5I-+6H+═3I2+3H2O及I2遇淀粉变蓝可知,检验食盐中存在IO3-,该反应需要酸性条件,需要碘离子,则选淀粉碘化钾试纸检验,生成的I2由淀粉检验;
故选A。

练习册系列答案
相关题目
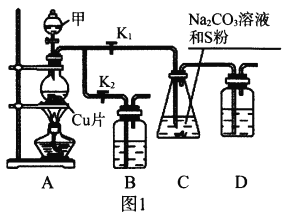
【题目】用如图所示装置和相应试剂能达到实验目的的是( )
选项 | 实验目的 | 试剂a | 试剂b | 试剂c | 装置 |
A | 验证非金属性:S>C>Si | 稀硫酸 | Na2CO3 | Na2SiO3溶液 |
|
B | 制备纯净的NO | 浓硝酸 | Cu | 水 | |
C | 检验溶液X中含有CO32- | 盐酸 | 溶液X | 澄清石灰水 | |
D | 除去Na2SO3中的Na2SO4 | 氯水 | 混合物 | NaOH溶液 |
A. A B. B C. C D. D