题目内容
9. 化学反应中所释放的热量在工业生产和科学研究中有着重要的作用.
化学反应中所释放的热量在工业生产和科学研究中有着重要的作用.(1)N2H4和H2O2混合可做火箭推进剂,已知:16g液态N2H4和足量氧气反应生成N2(g)和H2O(l),放出310.6kJ的热量:2H2O2(l)=O2(g)+2H2O(l)△H=-196.4kJ•mol-1.反应N2H4(g)+O2(g)=N2(g)+2H2O(l)的△H=-621.2kJ•mol-1.N2H4和H2O2反应生成N2(g)和H2O2(l)的热化学方程式为N2H4(l)+2H2O2(l)=N2(g)+4H2O(l)△H=-817.6kJ•mol-1 ;
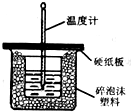
(2)实验室用50mL 0.50mol•L-1盐酸与50mL某浓度的NaOH溶液在如图所示装置中反应,通过测定混合液温度升高的情况计算中和热;
(3)该装置参照两处明显的错误,其中一处是缺少一种玻璃仪器,该仪器的名称为环形玻璃搅拌棒;
(4)实验室提供了0.50mol•L-1和0.55mol•L-1两种浓度的NaOH溶液,应选择0.55mol•L-1的溶液进行实验.
分析 (1)先写出液态联氨燃烧的热化学方程式,然后根据盖斯定律来解答;
(3)根据量热计的构造来判断该装置的缺少仪器;
(4)为了使反应充分,NaOH应过量.
解答 解:(1)16g液态N2H4和足量氧气反应生成N2(g)和H2O(l),放出310.6kJ的热量,热化学方程式为N2H4(l)+O2(g)=N2(g)+2H2O(l)△H=-621.2 kJ•mol-1①
2H2O2(l)=2H2O(l)+O2(g)△H=-196.4kJ•mol-1 ②
根据盖斯定律,①+②得:N2H4(l)+2H2O2(l)=N2(g)+4H2O(l)△H=-817.6kJ•mol-1 ,
故答案为:-621.2;N2H4(l)+2H2O2(l)=N2(g)+4H2O(l)△H=-817.6kJ•mol-1 ;
(3)根据量热计的构造可知该装置的缺少仪器是环形玻璃搅拌棒,故答案为:环形玻璃搅拌棒;
(4)实验室提供了0.50mol•L-1和0.55mol•L-1两种浓度的NaOH溶液,为了使反应充分,NaOH应过量,所以选择0.55mol•L-1的溶液进行实验,故答案为:0.55.
点评 本题考查热化学方程式的书写,热反应热的测定,题目难度大,注意理解测定反应热的原理.

练习册系列答案
相关题目
19.每克下列物质氧化放出能量最高的是( )
| A. | 蛋白质 | B. | 糖类 | C. | 油脂 | D. | 维生素 |
4.下列热化学方程式书写正确的是(△H的绝对值均正确)( )
| A. | C2H5OH(l)+3O2(g)═2CO2(g)+3H2O(g)△H=-1367.0 kJ/mol(燃烧热) | |
| B. | S(s)+O2(g)═SO2(g)△H=-269.8kJ/mol(反应热) | |
| C. | NaOH(aq)+HCl(aq)═NaCl(aq)+H2O(l)△H=+57.3kJ/mol(中和热) | |
| D. | 2NO2═O2+2NO△H=+116.2kJ/mol(反应热) |
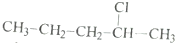

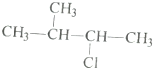
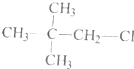
 利用核磁共振技术测定有机物分子的三维结构的研究获得了2002年诺贝尔化学奖.在有机物分子中,不同氢原子的核磁共振谱中给出的峰值(信号)也不同.根据峰值(信号)可以确定有机物分子中氢原子的种类和数目.
利用核磁共振技术测定有机物分子的三维结构的研究获得了2002年诺贝尔化学奖.在有机物分子中,不同氢原子的核磁共振谱中给出的峰值(信号)也不同.根据峰值(信号)可以确定有机物分子中氢原子的种类和数目. 发生酯化反应的产物.
发生酯化反应的产物.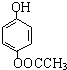 、
、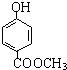 、
、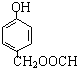 (其中之一).
(其中之一).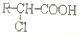

 .
. 电解原理在化学工业中有广泛应用.右图表示一个电解池,装有电解液c;A、B是两块电极板,通过导线与直流电源相连.请回答以下问题:
电解原理在化学工业中有广泛应用.右图表示一个电解池,装有电解液c;A、B是两块电极板,通过导线与直流电源相连.请回答以下问题: 如图所示是分离某种混合物时实验装置,请完成下列问题:
如图所示是分离某种混合物时实验装置,请完成下列问题: