题目内容
【题目】一种利用钛铁矿制备Li4Ti5O12的工艺流程如图:

已知:钛铁矿的主要成分是FeTiO3(可表示为FeO·TiO2),还含有少量的MgO和SiO2等杂质。
回答下列问题:
(1)酸浸时,要提高铁的浸出率可采取的措施是___(写出一条即可)。
(2)酸浸后的滤液①中钛主要以TiOCl42-形式存在,则其水解生成TiO2·xH2O的离子方程式为___,加热水的目的是___。
(3)TiO2·xH2O沉淀与双氧水、氨水反应时,应将温度控制在50℃左右的原因是___。
(4)若将滤液②加热至一定温度后,再加入双氧水和磷酸,恰好使Mg2+沉淀完全[溶液中c(Mg2+)降至1.0×10-5mol·L-1],此时溶液中![]() =___。已知:此温度下,FePO4、Mg3(PO4)2的溶度积常数分别为1.5×10-21、1.0×10-23。
=___。已知:此温度下,FePO4、Mg3(PO4)2的溶度积常数分别为1.5×10-21、1.0×10-23。
(5)高温煅烧时发生反应的化学反应方程式为___。
(6)某可充电的锂离子电池以Li4Ti5O12为正极,嵌入锂的碳材料为负极,含Li+导电固体为电解质。放电时的电池反应为LixC+Li4Ti5O12=Li(x-5)C+Li9Ti5O12,则充电时阴极电极反应式为___。
【答案】提高温度或将矿石粉粹或适当提高酸的浓度等 TiOCl42-+(x+1)H2OTiO2·xH2O↓+2H++4Cl- 促进水解 提高反应速率,同时防止温度过高造成双氧水分解,氨水挥发 1.5×10-12 Li2Ti5O11+Li2CO3![]() Li4Ti5O12+CO2↑ Li(x-5)C+5Li++5e-=LixC
Li4Ti5O12+CO2↑ Li(x-5)C+5Li++5e-=LixC
【解析】
用钛铁矿(主要成分为FeTiO3,还含有少量MgO、SiO2等杂质)来制备Li4Ti5O12,由制备流程可知,加盐酸酸浸溶解,SiO2与盐酸不反应,过滤后的滤渣为SiO2,滤液①中含Mg2+、Fe2+、TiOCl42-,对滤液①加热发生水解反应TiOCl42-+(x+1)H2OTiO2·xH2O↓+2H++4Cl-,水解后过滤,水解后的滤液②中含Mg2+、Fe2+,沉淀为TiO2xH2O,向沉淀中加入氨水、双氧水和LiOH反应过滤后得到Li2Ti5O15,再与碳酸锂高温下发生反应Li2Ti5O11+Li2CO3![]() Li4Ti5O12+CO2↑生成Li4Ti3O12,据此分析解答。
Li4Ti5O12+CO2↑生成Li4Ti3O12,据此分析解答。
(1)酸浸时,要提高铁的浸出率可采取的措施是提高温度或将矿石粉粹或适当提高酸的浓度等;
(2)酸浸后的滤液①中钛主要以TiOCl42-形式存在,则其水解生成TiO2·xH2O的离子方程式为TiOCl42-+(x+1)H2OTiO2·xH2O↓+2H++4Cl-,加热水的目的是促进水解;
(3)TiO2·xH2O沉淀与双氧水、氨水反应时,双氧水受热易分解,氨水受热易挥发,应将温度控制在50℃左右的原因是提高反应速率,同时防止温度过高造成双氧水分解,氨水挥发;
(4)若将滤液②加热至一定温度后,再加入双氧水和磷酸,恰好使Mg2+沉淀完全[溶液中c(Mg2+)降至1.0×10-5mol·L-1],根据Ksp[Mg3(PO4)2]=c3(Mg2+)×c2(PO43-),c(PO43-)=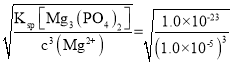 =1.0×10-4mol·L-1,Ksp(FePO4)=c(Fe3+)×c(PO43-),c(Fe3+) =
=1.0×10-4mol·L-1,Ksp(FePO4)=c(Fe3+)×c(PO43-),c(Fe3+) = 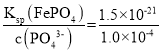 =1.5×10-17 mol·L-1,此时溶液中
=1.5×10-17 mol·L-1,此时溶液中![]() =
=![]() =1.5×10-12;
=1.5×10-12;
(5)根据分析,高温煅烧时发生反应的化学反应方程式为Li2Ti5O11+Li2CO3![]() Li4Ti5O12+CO2↑;
Li4Ti5O12+CO2↑;
(6)某可充电的锂离子电池以Li4Ti5O12为正极,嵌入锂的碳材料为负极,含Li+导电固体为电解质。放电时的电池反应为LixC+Li4Ti5O12=Li(x-5)C+Li9Ti5O12,则充电时为电解池,是放电时的逆过程,充电时的总反应为:Li(x-5)C+Li9Ti5O12![]() LixC+Li4Ti5O12,阴极上得电子,发生还原反应,电极反应式为Li(x-5)C+5Li++5e-=LixC。
LixC+Li4Ti5O12,阴极上得电子,发生还原反应,电极反应式为Li(x-5)C+5Li++5e-=LixC。

 科学实验活动册系列答案
科学实验活动册系列答案【题目】在体积为2L的恒容密闭容器中充入一定量的SO2和O2,发生反应:2SO2(g)+O2(g) ![]() 2SO3(g)反应在三种不同的条件下进行,反应物SO2的物质的量(mol)随反应时间(min)的变化情况如下表所示:
2SO3(g)反应在三种不同的条件下进行,反应物SO2的物质的量(mol)随反应时间(min)的变化情况如下表所示:
实验序号 | 时间 物质的量 温度 | 0 | 5 | 10 | 15 | 20 | 25 | 30 |
1 | 490℃ | 2.00 | 1.00 | 0.50 | 0.30 | 0.25 | 0.20 | 0.20 |
2 | 490℃ | 2.00 | 0.30 | 0.20 | 0.20 | 0.20 | 0.20 | 0.20 |
3 | 500℃ | 2.00 | 0.50 | 0.35 | 0.30 | 0.30 | 0.30 | 0.30 |
(1)对照实验1,实验2改变的某一外界条件可能是_______。
(2)反应达平衡后,向实验2中加入少量的18O2,一段时间18O后可能存在于哪些物质中________(填选项)。
A 只存在氧气 B 只存在三氧化硫 C 只存在反应物 D 存在反应物与生成物
(3)实验3中,在5~15min时段,用O2表示的平均反应速率为______ mol/(L·min)。
(4)若将实验1置于绝热体系中,测得实验到达平衡的时间比原来缩短了,则参加反应的SO2和O2的总能量______(填“>”、“<”或“=”)生成的SO3的总能量。
(5)能说明实验3达到平衡状态的标志是_______(任写一条)。
【题目】盐酸与碳酸钙反应生成CO2,运用下图,可测定该反应的速率.请根据要求填空:
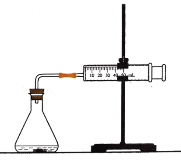
(1)连接好仪器后,需要检查_____________________,再加入药品进行实验.
(2)在锥形瓶中加入5g大理石,加入20mL 1mol·L1盐酸.每隔10s观测玻璃注射器中气体的体积,并以mL·s1为反应速率的单位,计算每10s时间间隔内的反应速率。数据处理的结果见下面的表格:
时间/s | 10 | 20 | 30 | 40 | 50 | 60 |
气体体积/mL | 4 | 14 | 25 | 38 | 47 | 55 |
反应速率/mL·s1 | 0.4 | 1.0 | 1.1 | ? | 0.9 | 0.8 |
表格中的“?”处应填的数据是_________________.
(3)从反应速率随时间变化的数据可知,本实验中反应速率与___________和__________有关