题目内容
11.已知标况下氯气和氢气的混合气体共22.4L,经过点燃充分反应之后,将反应后的混合气体通入氢氧化钠溶液中,反应完全后,共消耗氢氧化钠1.5mol,求原混合气体中氯气和氢气的体积比( )| A. | 2:1 | B. | 1:1 | C. | 1:2 | D. | 3:1 |
分析 如果氯气是否过量,生成的混合气体与氢氧化钠反应生成氯化钠和次氯酸钠,根据组成钠与氯之比为1:1;如果氢气过量或两者恰好完全反应生成的气体与氢氧化钠反应生成氯化钠,根据组成钠与氯之比也为1:1,所以原混合气体中氯气的物质的是为$\frac{1.5}{2}mol$,所以氢气的物质的量为:$\frac{22.4L}{22.4L/mol}$-$\frac{1.5}{2}mol$=0.25mol,由此分析解答.
解答 解:如果氯气是否过量,生成的混合气体与氢氧化钠反应生成氯化钠和次氯酸钠,根据组成钠与氯之比为1:1;如果氢气过量或两者恰好完全反应生成的气体与氢氧化钠反应生成氯化钠,根据组成钠与氯之比也为1:1,所以原混合气体中氯气的物质的是为$\frac{1.5}{2}mol$,所以氢气的物质的量为:$\frac{22.4L}{22.4L/mol}$-$\frac{1.5}{2}mol$=0.25mol,体积之比等于物质的量之比,所以混合气体中氯气和氢气的体积比0.75:0.25=3:1,故选D.
点评 本题考查混合物的计算,题目难度不大,注意掌握有关混合物反应的计算方法,本题解题关键是根据反应物判断最终产物的成分中钠与氯之比为1:1,求混合气体中氯气的量是关键.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
2.下列有关氢氧化铁悬浊液与氢氧化铁胶体的说法正确的是( )
| A. | 都可以发生丁达尔现象 | |
| B. | 分别滴加稀硫酸至过量,现象不同,最终产物相同 | |
| C. | 能透过半透膜 | |
| D. | 分散质颗粒直径都在1~100 nm之间 |
19.下列几种物质中不属于天然高分子化合物的是( )
| A. | 聚乙烯 | B. | 淀粉 | C. | 纤维素 | D. | 蛋白质 |
6.在强酸性溶液中能大量共存,且溶液为无色透明的离子组是( )
| A. | Na+、Al3+、SO42-、NO3- | B. | Ba2+、Na+、SO42-、NO3- | ||
| C. | K+、Mg2+、MnO4-、SO42- | D. | K+、Na+、NO3-、HCO3- |
16.在pH=1的溶液中,因发生氧化还原反应而不能大量共存的离子组是( )
| A. | Ca2+、Cl-、HCO3-、K+ | B. | ClO-、K+、SO42-、Ba2+ | ||
| C. | CH3COO-、K+、Na+、CO32- | D. | Fe2+、Ag+、NO3-、K+ |
3.下列事实,不能用勒夏特列原理解释的是( )
| A. | 反应CO+NO2?CO2+NO△H<0,升高温度可使平衡向逆反应方向移动 | |
| B. | 合成NH3的反应,为提高NH3的产率,理论上应采取相对较低温度的措施 | |
| C. | 溴水中存在平衡:Br2+H2O?HBr+HBrO,当加入AgNO3溶液后,溶液颜色变浅 | |
| D. | 对2HI(g)?H2(g)+I2(g),增大平衡体系的压强(压缩体积)可使体系颜色变深 |
20.在密闭容器中,下列可逆反应达到平衡后,升高温度可以使混合气体平均相对分子质量减小的是( )
| A. | H2(气)+Br2(气)?2HBr(气)△H<0 | B. | N2(气)+3H2(气)?2NH3(气)△H<0 | ||
| C. | N2O4?2NO2 △H>0 | D. | 4NH3(气)+5O2(气)?4NO(气)+6H2O(气)△H<0 |
15.加成反应也是有机化学中的一类重要的反应类型,下列各组物质中不能发生加成反应的是( )
| A. | 聚乙烯 | B. | 聚乙炔 | C. | 氯乙烯 | D. | 苯 |
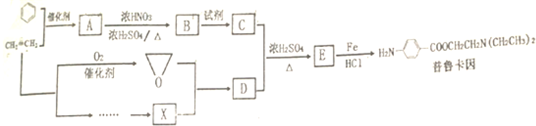
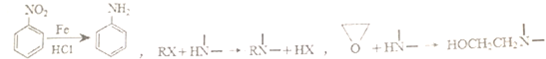
 .
.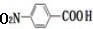 $→_{△}^{浓硫酸}$
$→_{△}^{浓硫酸}$ +H2O.
+H2O.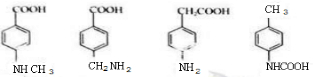 .
.