题目内容
【题目】(1)250 mL密度为1.1 g·cm-3、质量分数为24.5%的硫酸跟铁屑充分反应。计算生成H2的体积(标准状况)(给出必要的计算过程)
(2)上述反应中转移电子数目为多少?
(3)亚硝酸钠(NaNO2)具有致癌作用,许多腌制食品中含NaNO2。酸性KMnO4溶液与亚硝酸钠反应的离子反应为 MnO4-+NO2-+H+→Mn2+ + NO3-+H2O(未配平),下列叙述错误的( )
A.生成1mol Mn2+,转移电子为5mol
B.该反应中氮元素被氧化
C.配平后,水的化学计量数为3
D.反应中氧化产物与还原产物的物质的量之比为2:5
(4)向NaOH溶液中逐渐滴入Mg(HCO3)2溶液至沉淀完全的离子方程______________
(5)现有铜片、锌片、导线、小灯泡![]() 、电流表
、电流表![]() 、硫酸铜溶液及烧杯
、硫酸铜溶液及烧杯![]() ,设计实验证明氧化还原反应中有电子转移。要求画图表示及必要的文字说明。
,设计实验证明氧化还原反应中有电子转移。要求画图表示及必要的文字说明。
【答案】(1)15.4L(2)1.4NA(3)D
(4)Mg2++2HCO3-+4OH-=Mg(OH)2↓+2CO32-+2H2O
(5)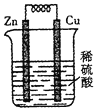 连小灯泡——发亮或电流表 指针偏转
连小灯泡——发亮或电流表 指针偏转
【解析】
试题分析:(1)250 mL密度为1.1 g·cm-3、质量分数为24.5%的硫酸的物质的量是![]() ,所以根据方程式Fe+H2SO4=FeSO4+H2↑可知生成H2的体积为0.6875mol×22.4L/mol=15.4L;
,所以根据方程式Fe+H2SO4=FeSO4+H2↑可知生成H2的体积为0.6875mol×22.4L/mol=15.4L;
(2)上述反应中转移电子的物质的量是0.6875mol×2=1.375mol,其数目约为1.4NA;
(3)A.Mn元素化合价从+7价降低到+2价,因此生成1mol Mn2+,转移电子为5mol,A正确;B.该反应中氮元素化合价从+3价升高到+5价,失去电子被氧化,B正确;C.根据电子得失守恒和原子守恒可知配平后的方程式为2MnO4-+5NO2-+6H+=2Mn2+ +5NO3-+3H2O,C正确;D.根据以上分析可知反应中氧化产物是硝酸根,还原产物是锰离子,二者的物质的量之比为5:2,D错误,答案选D。
(4)向NaOH溶液中逐渐滴入Mg(HCO3)2溶液至沉淀完全的离子方程为Mg2++2HCO3-+4OH-=Mg(OH)2↓+2CO32-+2H2O;
(5)可以利用原电池中灯泡是否发亮或电流计指针是否偏转判断是否有电子转移。

 开心蛙口算题卡系列答案
开心蛙口算题卡系列答案