题目内容
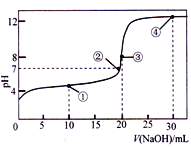
【题目】电导率是衡量电解质溶液导电能力大小的物理量,根据溶液电导率变化可以确定滴定反应的终点。在一定温度下,用0.1mol/LKOH溶液分别滴定体积均为20mL、浓度均为0.1mol/L的盐酸和醋酸溶液,滴定曲线如图所示。下列有关判断正确的是
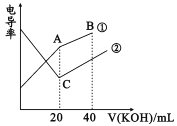
A. B点的溶液中有:c(K+)>c(OH-)>c(CH3COO-)>c(H+)
B. A点的溶液中有:c(CH3COO-)+c(OH-)-c(H+)=0.1mol/L
C. C点水电离的c(OH-)大于A点水电离的c(OH-)
D. A、B、C三点溶液均有Kw=c(H+)·c(OH-)=1.0×10-14
【答案】A
【解析】溶液电导率与离子浓度成正比,HCl是强电解质、醋酸是弱电解质,所以相同浓度的盐酸和醋酸,盐酸中离子浓度大于醋酸,则相同浓度的盐酸和醋酸,盐酸电导率较大,根据图象知,①是醋酸和KOH的混合、②是HCl和KOH的混合。A. B点溶液中KOH过量,溶液中溶质为等物质的量浓度的CH3COOK和KOH,醋酸根离子水解生成OH-,但水解程度较小,溶液呈强碱性,则离子浓度大小顺序是c(K+)>c(OH-)>c(CH3COO-)>c(H+),A项正确;B.A点溶液中,醋酸和KOH恰好完全反应生成CH3COOK,溶液中存在电荷守恒,则c(CH3COO-)+c(OH-)-c(H+)═c(K+),A点溶液体积增大一倍,则离子浓度降为原来的一半,所以c(CH3COO-)+c(OH-)-c(H+)═c(K+)=0.05mol/L,B项错误;C .C点HCl和KOH恰好完全反应生成KCl,对水的电离无影响;A的溶质为CH3COOK,促进水电离,所以C点水电离的c(OH-)小于A点水电离的c(OH-),C项错误;D.离子积常数与温度有关,温度相同,离子积常数相同,温度不一定是常温,数值不一定是1.0×10-14,D项错误;故选B。

 口算题天天练系列答案
口算题天天练系列答案【题目】下列有关实验现象和解释或结论都正确的选项是( )
选项 | 实验操作 | 现象 | 解释或结论 |
A | 把SO2通入紫色石蕊试液中 | 紫色褪去 | SO2具有漂白性 |
B | 把浓硫酸滴到pH试纸上 | 试纸变红 | 浓硫酸具有酸性 |
C | 将充满NO2的密闭玻璃球浸泡在热水中 | 红棕色变浅 | 反应2NO2 N2O4的ΔH<0 |
D | 向AgCl沉淀中滴加KI溶液 | 白色沉淀 变为黄色 | 溶度积:AgI比 AgCl更小 |
A. A B. B C. C D. D